
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀. 试回答下列问题:
(1)A元素的同位素有(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为
(3)C,D,E,F的简单离子半径由大到小的顺序是(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱(举一例)
(5)下列有关G的说法不正确的是 A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示.请写出t2时反应的总的化学方程式 . 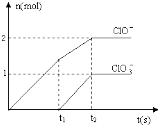
【答案】
(1)1H、2H、3H
(2)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3)S2﹣>Cl﹣>O2﹣>Al3+
(4)H2O比H2S稳定
(5)A、B、D
(6)5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O
【解析】解:A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;C元素原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子数,最外层电子数为6,故C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,只能处于第三周期,故D为Al;E元素原子的最外层电子数是其电子层数的2倍,原子序数大于Al,处于第三周期,最外层电子数为6,故E为S元素;G单质是日常生活中用量最大的金属,易被腐蚀,则G为Fe.(1)A为H元素,其同位素有:1H、2H、3H,所以答案是:1H、2H、3H;(2)B的简单氢化物为NH3 , 实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2﹣>Cl﹣>O2﹣>Al3+ , 所以答案是:S2﹣>Cl﹣>O2﹣>Al3+;(4)水比硫化氢稳定等可以说明氧元素非金属性比硫的强,所以答案是:H2O比H2S稳定;(5)A.在人体内的血红蛋白中含有铁元素,铁位于第四周期Ⅷ族,故A错误;B.过量的铁与氯气反应生成氯化铁,而Fe与稀盐酸反应生成氯化亚铁,故B错误;C.氯气与Fe反应生成FeCl3 , Fe与氯化铁反应生成FeCl2 , 氢氧化亚铁氧化生成Fe(OH)3 , 都可以通过化合反应制取,故C正确;D.铁离子具有强氧化性,可以氧化碘离子,氢氧化铁与HI溶液发生中和反应外,还发生氧化还原反应,故D错误,故选:ABD;(6)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,根据电子转移守恒可知生成氯离子为
CaCl2+2NH3↑+2H2O;(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2﹣>Cl﹣>O2﹣>Al3+ , 所以答案是:S2﹣>Cl﹣>O2﹣>Al3+;(4)水比硫化氢稳定等可以说明氧元素非金属性比硫的强,所以答案是:H2O比H2S稳定;(5)A.在人体内的血红蛋白中含有铁元素,铁位于第四周期Ⅷ族,故A错误;B.过量的铁与氯气反应生成氯化铁,而Fe与稀盐酸反应生成氯化亚铁,故B错误;C.氯气与Fe反应生成FeCl3 , Fe与氯化铁反应生成FeCl2 , 氢氧化亚铁氧化生成Fe(OH)3 , 都可以通过化合反应制取,故C正确;D.铁离子具有强氧化性,可以氧化碘离子,氢氧化铁与HI溶液发生中和反应外,还发生氧化还原反应,故D错误,故选:ABD;(6)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,根据电子转移守恒可知生成氯离子为 ![]() =0.7mol,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,t2时氯气和氢氧化钠的反应方程式为:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O,所以答案是:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.
=0.7mol,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,t2时氯气和氢氧化钠的反应方程式为:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O,所以答案是:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.


科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下:
(1)反应I:C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol﹣1 , 通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用: .
(2)反应II:CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1 . 如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系: .
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 .
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 .
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)△H1=﹣41kJmol﹣1
2H2(g)+O2(g)2H2O(g)△H2=﹣484kJmol﹣1
CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=﹣802kJmol﹣1
反应IV:CO(g)+3H2(g)CH4(g)+H2O(g)△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是
A. 利用了SO2的水溶性,将SO2直接通入水中
B. 利用了SO2的氧化性,将SO2直接通入水中
C. 利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D. 利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,A元素形成的﹣2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到CO2能生成A的单质.C为原子核内有12个中子的二价金属,当2.4g C与足量盐酸反应时,生成标准状况下的H2 2.24L.D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子.回答下列问题.
(1)C离子的结构示意图
(2)A、E氢化物的稳定性比较(填化学式)
(3)A,B,C,D四种离子半径由大到小顺序(用离子符号表示).
(4)用电子式表示C与D形成化合物的形成过程: .
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式: .
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
卤素原子 | F | Cl | Br | I |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. FB. ClC. BrD. I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4﹣(绿色)、Cr2O72﹣(橙红色)、CrO42﹣(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 .
(2)CrO42﹣和Cr2O72﹣在溶液中可相互转化.室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72﹣)随c(H+)的变化如图所示.
①用离子方程式表示Na2CrO4溶液中的转化反应 .
②由图可知,溶液酸性增大,CrO42﹣的平衡转化率(填“增大“减小”或“不变”).根据A点数据,计算出该转化反应的平衡常数为 .
③升高温度,溶液中CrO42﹣的平衡转化率减小,则该反应的△H(填“大于”“小于”或“等于”).
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl﹣ , 利用Ag+与CrO42﹣生成砖红色沉淀,指示到达滴定终点.当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c(Ag+)为molL﹣1 , 此时溶液中c(CrO42﹣)等于molL﹣1 . (已知Ag2 CrO4、AgCl的Ksp分别为2.0×10﹣12和2.0×10﹣10).
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+ , 反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《天工开物》中记了砒霜的制取:“凡烧砒,下鞠土窑,纳石其上,上砌曲突,以铁釜倒悬履突口。其下灼炭举火,其烟气从曲突内熏贴釜上”。文中涉及的操作方法可用于( )
A.从石油中获得汽油
B.分离单质碘和氯化钠的固体混合物
C.苯甲酸的重结晶
D.从溴水中提取溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol?L﹣1 CH3COOH溶液中加入少量水,溶液中 ![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中 ![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中 ![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 ![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com