
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D
【答案】D
【解析】解:A.铁与稀盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+═Fe2++H2↑,提供的离子方程式错误,评价不合理,故A错误;
B.大理石溶于醋酸的反应,碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO﹣ , 题中评价不合理,故B错误;
C.FeCl3溶液“腐蚀”铜箔,二者反应生成氯化亚铁和硫化铜,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+ , 题中离子方程式错误,评价不合理,故C错误;
D.NH4HCO3溶液与过量KOH浓溶液共热,氢氧化钾过量,题中漏掉了碳酸氢根离子的反应,正确的离子方程式为:2OH﹣+NH4++HCO3﹣ ![]() CO32﹣+NH3↑+2H2O,该评价合理,故D正确;
CO32﹣+NH3↑+2H2O,该评价合理,故D正确;
故选D.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40mol NO2气体充入2L的密闭容器中,发生如下反应:2NO2(g)N2O4(g)△H<0.监测反应获得如表数据:下列说法正确的是( )
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
A.0~20 s内,v(NO2)=0.005 mol?L﹣1?s﹣1
B.59 s时,c(NO2)一定大于0.12 mol?L﹣1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K> ![]()
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关.下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝
B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖
D.土豆中的淀粉经水解可变成酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO47H2O)的工业流程示意图如图: 
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 .
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 .
(3)反应釜中,烧渣经过反应转化为溶液I和固体.
①烧渣中的FeS在反应中做剂(填“氧化”或“还原”).
②溶液I中所含溶质的化学式是 .
(4)操作a的主要步骤是:加热浓缩、、过滤洗涤.
(5)流程中,固体X可以选择硫铁矿(FeS2)或;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2++═Fe2++SO42﹣+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下: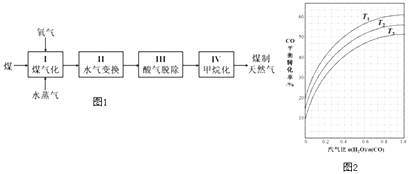
(1)反应I:C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol﹣1 , 通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用: .
(2)反应II:CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1 . 如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系: .
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 .
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 .
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)△H1=﹣41kJmol﹣1
2H2(g)+O2(g)2H2O(g)△H2=﹣484kJmol﹣1
CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=﹣802kJmol﹣1
反应IV:CO(g)+3H2(g)CH4(g)+H2O(g)△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.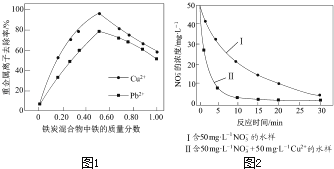
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为:4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O。
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或说法中,正确的是( )
A.中子数为8的氮原子:8N
B.次氯酸的电子式: ![]()
C.PCl5分子的每个原子都满足8电子稳定结构
D.用电子式表示NaCl的形成过程: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀. 试回答下列问题:
(1)A元素的同位素有(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为
(3)C,D,E,F的简单离子半径由大到小的顺序是(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱(举一例)
(5)下列有关G的说法不正确的是 A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示.请写出t2时反应的总的化学方程式 . 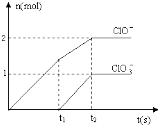
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com