
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO47H2O)的工业流程示意图如图: 
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 .
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 .
(3)反应釜中,烧渣经过反应转化为溶液I和固体.
①烧渣中的FeS在反应中做剂(填“氧化”或“还原”).
②溶液I中所含溶质的化学式是 .
(4)操作a的主要步骤是:加热浓缩、、过滤洗涤.
(5)流程中,固体X可以选择硫铁矿(FeS2)或;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2++═Fe2++SO42﹣+ .
【答案】
(1)增大反应物的接触面积,提高化学反应速率
(2)2SO2+O2 ![]() 2SO3
2SO3
(3)还原;Fe2(SO4)3、H2SO4
(4)冷却结晶
(5)Fe;14Fe3+;8H2O;16H+
【解析】解:(1)沸腾炉中,硫铁矿进行粉碎处理的目的是使固体与气体充分接触,加快反应速率,
故答案为:增大反应物的接触面积,提高化学反应速率;(2)接触室中,SO2与O2的反应生成SO3 , 反应的化学方程式为2SO2+O2 ![]() 2SO3 ,
2SO3 ,
故答案为:2SO2+O2 ![]() 2SO3;(3)①反应釜中的FeS被氧化成硫,所以FeS在反应中做还原剂,
2SO3;(3)①反应釜中的FeS被氧化成硫,所以FeS在反应中做还原剂,
故答案为:还原;
②根据上面的分析可知,溶液Ⅰ主要成分为硫酸铁及过量的硫酸,其化学式为Fe2(SO4)3、H2SO4 ,
故答案为:Fe2(SO4)3、H2SO4;(4)操作a为从硫酸亚铁溶液中获得硫酸亚铁晶体,其操作为加热浓缩、冷却结晶、过滤洗涤,
故答案为:冷却结晶;(5)流程中,固体X主要目的是将铁离子还原成亚铁离子,所以X可以是FeS2或Fe,硫铁矿(FeS2)与硫酸铁发生氧化还原反应生成亚铁离子和硫酸根离子,反应的离子方程式为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+ ,
故答案为:Fe;14Fe3+、8H2O、16H+ .
硫铁矿在沸腾炉中高温生成氧化铁与二氧化硫,混合气体Ⅰ为二氧化硫和空气,经过接触室后二氧化硫被氧化成三氧化硫,所以混合气体Ⅱ为三氧化硫、二氧化硫、空气等,沸腾炉中产生的炉渣主要为硫化亚铁、氧化铁、二氧化硅等,加入硫酸溶解,再用氧气氧化可得溶液Ⅰ主要成分为硫酸铁,硫酸铁中加入铁粉得溶液Ⅱ为硫酸亚铁溶液,经蒸发浓缩、冷却结晶得到硫酸亚铁晶体,烧渣用酸溶解后得固体主要成分为二氧化硅和硫,硫经氧化得二氧化硫,可循环利用,(1)固体粉碎处理可使固体与气体充分接触,加快反应速率;(2)接触室中,SO2与O2的反应生成SO3;(3)①反应釜中的FeS被氧化成硫,据此答题;②根据上面的分析可知,溶液Ⅰ主要成分为硫酸铁及过量的硫酸;(4)操作a为从硫酸亚铁溶液中获得硫酸亚铁晶体,可以用降温结晶的方法;(5)流程中,固体X主要目的是将铁离子还原成亚铁离子,据此书写离子方程式.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL﹣1 | 溶液的密度/gcm﹣3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的质量分数为(不写单位,用含c1、ρ1 , 的代数式表示).
(2)物质的量浓度为c1molL﹣1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为molL﹣1 .
(3)将物质的量浓度分别为c2molL﹣1和 ![]() c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度
c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度 ![]() c2molL﹣1(设混合后溶液的体积变化忽略不计)
c2molL﹣1(设混合后溶液的体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100molL﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) 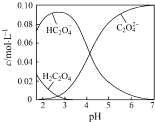
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣)
B.c(Na+)=0.100 molL﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣)
C.c(HC2O4﹣)=c(C2O42﹣)的溶液中:c(Na+)>0.100 molL﹣1+c(HC2O4﹣)
D.pH=7的溶液中:c(Na+)>2c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO28H2O)是一种在水产养殖中广泛使用的供氧剂.
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO28H2O.
Ca(OH)2+H2O2+6H2O═CaO28H2O
反应时通常加入过量的Ca(OH)2 , 其目的是 .
(2)向池塘水中加入一定量的CaO28H2O后,池塘水中浓度增加的离子有(填序号).
A.Ca2+
B.H+
C.CO32﹣
D.OH﹣
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4 , 将MnO(OH)2与I﹣完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O62﹣
S4O62﹣
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式 .
②取加过一定量CaO28H2O的池塘水样100.00mL,按上述方法测定水中溶解氧量,消耗0.01000molL﹣1Na2S2O3标准溶液13.50mL.计算该水样中的溶解氧(用mgL﹣1表示),写出计算过程.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.生产K2FeO4的工艺流程如图所示: 
(1)写出“氧化”过程中生成Na2FeO4的化学方程式: .
(2)“转化”过程中发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示.当溶液pH约为4时,停止反应.在20℃静置结晶,生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O.
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是 .
(3)析出固体的反应液经减压抽滤,洗涤,25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 , 其可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,A元素形成的﹣2价阴离子比氦的核外电子数多8个.B元素的一种氧化物为淡黄色固体,该固体遇到CO2能生成A的单质.C为原子核内有12个中子的二价金属,当2.4g C与足量盐酸反应时,生成标准状况下的H2 2.24L.D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子.回答下列问题.
(1)C离子的结构示意图
(2)A、E氢化物的稳定性比较(填化学式)
(3)A,B,C,D四种离子半径由大到小顺序(用离子符号表示).
(4)用电子式表示C与D形成化合物的形成过程: .
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式: .
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com