
【题目】过氧化钙(CaO28H2O)是一种在水产养殖中广泛使用的供氧剂.
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO28H2O.
Ca(OH)2+H2O2+6H2O═CaO28H2O
反应时通常加入过量的Ca(OH)2 , 其目的是 .
(2)向池塘水中加入一定量的CaO28H2O后,池塘水中浓度增加的离子有(填序号).
A.Ca2+
B.H+
C.CO32﹣
D.OH﹣
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4 , 将MnO(OH)2与I﹣完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:O2![]() MnO(OH)2
MnO(OH)2![]() I2
I2![]() S4O62﹣
S4O62﹣
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式 .
②取加过一定量CaO28H2O的池塘水样100.00mL,按上述方法测定水中溶解氧量,消耗0.01000molL﹣1Na2S2O3标准溶液13.50mL.计算该水样中的溶解氧(用mgL﹣1表示),写出计算过程.
【答案】
(1)提高过氧化氢的利用率
(2)A,D
(3)
①O2+2Mn2++4OH﹣=2MnO(OH)2↓
②I2+2S2O32﹣=2I﹣+S4O62﹣,n(I2)= ![]() =
= ![]() =6.750×10﹣5mol,
=6.750×10﹣5mol,
n(MnO(OH)2)=n(I2)=6.750×10﹣5mol,
n(O2)= ![]() n(MnO(OH)2)=
n(MnO(OH)2)= ![]() ×6.750×10﹣5mol=3.375×10﹣5mol,
×6.750×10﹣5mol=3.375×10﹣5mol,
水中溶解氧= ![]() =10.80mg/L,
=10.80mg/L,
答:该水样中的溶解氧10.80mg/L.
【解析】(1)依据方程式Ca(OH)2+H2O2+6H2O═CaO28H2O可知,反应时加入氢氧化钙是为了提高双氧水的利用率,所以答案是:提高过氧化氢的利用率;
(2)过氧化钙与水反应生成氢氧化钙、氧气和水,因此箱池水塘中加入一定量的CaO28H2O,池塘水中浓度增加的离子有钙离子和氢氧根离子,选择AD,所以答案是:AD;
(3)①O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可确定反应的离子方程式,所以答案是:O2+2Mn2++4OH﹣=MnO(OH)2;
②I2+2S2O32﹣=2I﹣+S4O62﹣ , n(I2)= ![]() =
= ![]() =6.750×10﹣5mol,
=6.750×10﹣5mol,
n(MnO(OH)2)=n(I2)=6.750×10﹣5mol,
n(O2)= ![]() n(MnO(OH)2)=
n(MnO(OH)2)= ![]() ×6.750×10﹣5mol=3.375×10﹣5mol,水中溶解氧=
×6.750×10﹣5mol=3.375×10﹣5mol,水中溶解氧= ![]() =10.80mg/L,
=10.80mg/L,
答:该水样中的溶解氧10.80mg/L.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知碳有三种常见的同位素:12C、13C、14C,氧也有三种同位素:16O、17O、18O,由这六种微粒构成的二氧化碳分子最多有( )
A. 8种B. 12种C. 18种D. 24种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16.
(1)W单质的电子式是 .
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因: .
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是 .
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是
(5)X与Z的单质之间发生反应的化学方程式是 .
(6)已知Q与Z是位于相邻周期的同主族元素.某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ=5.6×107 , KZ=9.7×1012 . Q的元素符号是 , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解无关的是
A.明矾和FeCl3可作净水剂
B.为保存FeCl3溶液,要在溶液中加少量盐酸
C.用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
D.氢氟酸用塑料试剂瓶保存而不用玻璃试剂瓶保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关.下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝
B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖
D.土豆中的淀粉经水解可变成酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO47H2O)的工业流程示意图如图: 
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 .
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 .
(3)反应釜中,烧渣经过反应转化为溶液I和固体.
①烧渣中的FeS在反应中做剂(填“氧化”或“还原”).
②溶液I中所含溶质的化学式是 .
(4)操作a的主要步骤是:加热浓缩、、过滤洗涤.
(5)流程中,固体X可以选择硫铁矿(FeS2)或;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2++═Fe2++SO42﹣+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.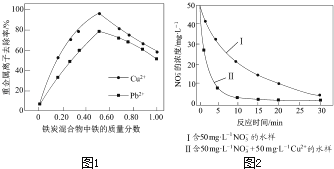
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为:4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O。
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体.向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应,则下列分析正确的是( ) 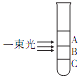
A.该区域是A,该区域中AgCl的直径最小
B.该区域是B,该区域中AgCl的直径介于
A.C区域之间
B.该区域是C,该区域中AgCl的直径最大
C.各区域AgCl的大小都相同,但只有B区域中分散质的大小介于1~100 nm之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com