
����Ŀ��[ʵ�黯ѧ]
���������ƣ�Na2S2O5���dz��õĿ����������ڿ����У�����ʱ���ֽ⣮ʵ�����Ʊ�����Na2S2O5�ķ������ڲ��Ͻ����£����Ʒ�Ӧ�¶���40�����ң���Na2CO3��������Һ��ͨ��SO2 �� ʵ��װ����ͼ��ʾ������ҺpHԼΪ4ʱ��ֹͣ��Ӧ����20�澲�ýᾧ������Na2S2O5�Ļ�ѧ����ʽΪ��2NaHSO3�TNa2S2O5+H2O��
��1��SO2��Na2CO3��Һ��Ӧ����NaHSO3��CO2 �� �����ӷ���ʽΪ ��
��2��װ��Y�������� ��
��3����������ķ�ӦҺ����ѹ���ˣ�ϴ�ӣ�25�橁30�����ɻ��Na2S2O5���壮
����ɼ�ѹ����װ�õ���Ҫ�����Dz���©�����ͳ����ã�
�������ñ���SO2ˮ��Һ����ˮ�Ҵ�ϴ��Na2S2O5���壬�ñ���SO2ˮ��Һϴ�ӵ�Ŀ���� ��
��4��ʵ���Ƶõ�Na2S2O5�����к���һ������Na2SO3 ��Na2SO4 �� ����ܵ�ԭ���� ��
���𰸡�
��1��2SO2+CO32��+H2O=2HSO3��+CO2
��2����ֹ����
��3������ƿ������Na2S2O5��ˮ�е��ܽ�
��4�����Ʊ�������Na2S2O5�ֽ�����Na2SO3 �� ��Na2SO3�ױ���������Na2SO4
���������ڲ��Ͻ����£����Ʒ�Ӧ�¶���40�����ң���Na2CO3��������Һ��ͨ��SO2 �� ������Ӧ����NaHSO3��CO2 �� ����Ķ��������������������Һ���գ��������������������������Һ��YΪ��ȫƿ���ɷ�ֹ������
��1����Na2CO3��������Һ��ͨ��SO2 �� ������Ӧ����NaHSO3��CO2 �� ��Ӧ�����ӷ���ʽΪ2SO2+CO32��+H2O=2HSO3��+CO2 ��
�ʴ�Ϊ��2SO2+CO32��+H2O=2HSO3��+CO2��
��2��������������������������Һ��YΪ��ȫƿ���ɷ�ֹ�������ʴ�Ϊ����ֹ������
��3������ɼ�ѹ����װ�õ���Ҫ�����Dz���©��������ƿ�ͳ����ã��ʴ�Ϊ������ƿ�����ɷ�Ӧ2NaHSO3�TNa2S2O5+H2O��֪������HSO3����Ũ�ȣ�����������Na2S2O5 �� �ñ���SO2ˮ��Һϴ�ӣ��ɽ���Na2S2O5���ܽ�ȣ�����Na2S2O5���ܽ⣬�ʴ�Ϊ������Na2S2O5��ˮ�е��ܽ⣻��4��Na2S2O5�ֽ�����Na2SO3 �� ��Na2SO3�ױ���������֪���Ƶõ�Na2S2O5�����к���һ������Na2SO3 ��Na2SO4 �� �ʴ�Ϊ�����Ʊ�������Na2S2O5�ֽ�����Na2SO3 �� ��Na2SO3�ױ���������Na2SO4 ��
���⿼�����ʵ��Ʊ���Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ�����ʵ�������Ŀ��飬�����ע��������ʵ������Լ������Ϣ��Ҫ������ʵ��ʵ�����֪ʶ���ѶȲ���


 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��ԭ������������������ֶ�����Ԫ�أ�W����̬�⻯����ʹ��ɫʯ����Һ������W��X����Ԫ�ص�����������ˮ���������Y�������������Ӧ��W��X��Y��Z������������֮��Ϊ16��
��1��W���ʵĵ���ʽ�� ��
��2�����û�ѧ�������W����̬�⻯����ʹ��ɫʯ����Һ������ԭ�� ��
��3����֪AsԪ�ص�ԭ������Ϊ33����W��ͬһ���壬As��Ԫ�����ڱ��е�λ���� ��
��4��W������������ˮ������Y�������������Ӧ�����ӷ���ʽ��
��5��X��Z�ĵ���֮�䷢����Ӧ�Ļ�ѧ����ʽ�� ��
��6����֪Q��Z��λ���������ڵ�ͬ����Ԫ�أ�ij�¶��£�����Ԫ�ص���̬������H2�������Ϸ�Ӧ������̬�⻯���ƽ�ⳣ���ֱ�ΪKQ=5.6��107 �� KZ=9.7��1012 �� Q��Ԫ�ط����� �� ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ�ɷ�FeS2������������̷���FeSO47H2O���Ĺ�ҵ����ʾ��ͼ��ͼ�� 
��1������¯�У���������з��鴦����Ŀ���� ��
��2���Ӵ����У���������Ҫ��Ӧ��SO2��O2�ķ�Ӧ���仯ѧ����ʽ�� ��
��3����Ӧ���У�����������Ӧת��Ϊ��ҺI���壮
�������е�FeS�ڷ�Ӧ�����������������ԭ������
����ҺI���������ʵĻ�ѧʽ�� ��
��4������a����Ҫ�����ǣ�����Ũ����������ϴ�ӣ�
��5�������У�����X����ѡ��������FeS2������������XΪ������FeS2��ʱ������ҺI�����X������Ӧ�����ӷ���ʽ����������
FeS2++�TFe2++SO42��+ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̿������м�ͻ���̿�Ļ������������۾������ڴ���ˮ����Ⱦ�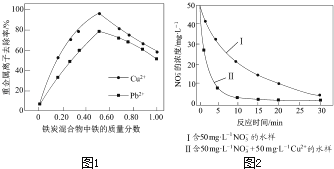
��1����̿�������ˮ��Һ�п��γ�������أ�������Cr2O72�������Է�ˮͨ����̿���������������Cr2O72��ת��ΪCr3+ �� ��缫��ӦʽΪ ��
��2������ͬ�����£�������������ͬ����������������ͬ����̿������ˮ��Cu2+��Pb2+��ȥ���ʣ������ͼ1��ʾ��
�ٵ���̿�������������������Ϊ0ʱ��Ҳ��ȥ��ˮ��������Cu2+��Pb2+ �� ��ԭ���� ��
�ڵ���̿�����������������������50%ʱ�����������������������ӣ�Cu2+��Pb2+��ȥ���ʲ�������������Ҫԭ���� ��
��3���������ۿ����ڴ�������ˮ�е���Ⱦ�
��һ�������£���FeSO4��Һ�еμӼ���NaBH4��Һ����Һ��BH4����BԪ�صĻ��ϼ�Ϊ+3����Fe2+��Ӧ�����������ۡ�H2��B��OH��4�� �� �����ӷ���ʽΪ ��
������������ˮ��NO3����Ӧ�����ӷ���ʽΪ:4Fe+NO3��+10H+�T4Fe2++NH4++3H2O��
�о����֣���pHƫ�ͽ��ᵼ��NO3����ȥ�����½�����ԭ���� ��
����ͬ�����£���������ȥ����ͬˮ����NO3���������нϴ���죨��ͼ2���������ò���Ŀ���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǻ�����ij��Ӧ�Ļ�ѧ��Ӧ�����淴Ӧʱ��仯��ʾ��ͼ������������ʾ��ͼ������ϵ��ǣ� �� 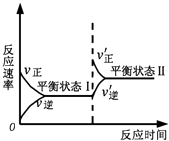
A.��Ӧ��ƽ��ʱ������Ӧ���ʺ��淴Ӧ�������
B.�÷�Ӧ�ﵽƽ��״̬���С��Ӧ��Ũ�ȣ�ƽ�ⷢ���ƶ����ﵽƽ��״̬��
C.�÷�Ӧ�ﵽƽ��״̬�������Ӧ��Ũ�ȣ�ƽ�ⷢ���ƶ����ﵽƽ��״̬��
D.ͬһ�ַ�Ӧ����ƽ��״̬���ƽ��״̬��ʱŨ�Ȳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ���ʽṹ�Ļ�ѧ�����˵���У���ȷ���ǣ� ��
A.������Ϊ8�ĵ�ԭ�ӣ�8N
B.������ĵ���ʽ�� ![]()
C.PCl5���ӵ�ÿ��ԭ�Ӷ�����8�����ȶ��ṹ
D.�õ���ʽ��ʾNaCl���γɹ��̣� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.����������
B.�ӵ�ʳ�κ��е���أ�KIO3��
C.����������Ԫ�ؾ���ά����
D.����������Ԫ�ز����ǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ��������еķ�ɢ������ʵ������һ�����ɺܶࡰAgCl����϶��ɵļ����壮��ʢ��NaCl��Һ���Թ��еμ�AgNO3��Һ�����ú���һ���������Թܣ������Թܵ�������ͬ������ֻ��һ������������ԵĶ����ЧӦ�������з�����ȷ���ǣ� �� 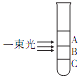
A����������A����������AgCl��ֱ����С
B����������B����������AgCl��ֱ������
A.C����֮��
B.��������C����������AgCl��ֱ�����
C.������AgCl�Ĵ�С����ͬ����ֻ��B�����з�ɢ�ʵĴ�С����1��100 nm֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���Ա�ʾ��ͼ�������仯���ǣ� �� 
A.Al��Fe2O3�����ȷ�Ӧ
B.Ba��OH��28H2O��NH4Cl�ķ�Ӧ
C.NaOH��Һ��CH3COOH��Һ��Ӧ
D.������O2�е�ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com