
����Ŀ����ͷ�����ػ������ҩ�ﻯѧ������ѧ������Ӧ�ù㷺���ش��������⣺
(1)��̬��ԭ�ӵ���Χ�����Ų�ʽΪ_________________�����У�2����3����4����5�ȶ��ֻ��ϼۣ��������ȶ��Ļ��ϼ���______________��VO43-�����幹��Ϊ__________��
(2)2-�ϻ��������������(ͼ1)�Ǹ����ý�С����Ч����Ѫ�ǵ�����ҩ�
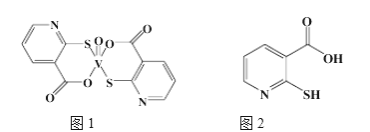
�ٸ�ҩ����Nԭ�ӵ��ӻ���ʽ��____________���������ڶ�����Ԫ�ص�һ�����ܰ��ɴ�С˳���������__________________��
��2-�ϻ�����(ͼ2)ˮ��������2-�����������������ԭ����_________________________________��
(3)��ԭ�ӷ����и�ԭ������ͬһƽ�棬�����ƽ�е�p�������p���ӿ��ڶ��ԭ�Ӽ��˶����γ������������������������д�������������������________��
A��SO2������B��SO42-������C��H2S������D��CS2
(4)ij���������ᄃ��ľ�����ͼ3��ʾ��ͼ4Ϊ�þ����ĸ���ͼ���þ������ܶ�Ϊ________________ g��cm��3(�г�����ʽ����)��
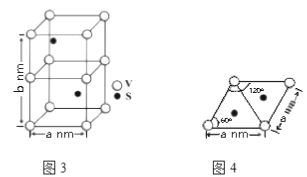
���𰸡�3d34s2 +5 �������� sp2 N>O>C 2�ϻ�������ˮ�����γ������������ˮ���Ի���� AD 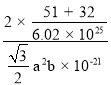
��������
��1����ԭ��Ϊ23��Ԫ�أ���Χ�����Ų�ʽΪ3d34s2�������ȶ��Ļ��ϼ�Ӧ��+5����ʧȥ���еļ۵��ӣ��γ������8���ӵ��ȶ��ṹ�����ݼ۲���ӶԻ���ԭ����VO43-�е�����ԭ��V�ļ۵���Ϊ5����������۲���Ӷ���Ϊ4�����Կռ乹��Ϊ�������壻
��2����Nԭ������ऻ��У���ऻ������ڱ����Ľṹ����Nԭ��Ϊsp2�ӻ������к��еĵڶ�����Ԫ����C��N��O��ͬ����Ԫ�ش������ҵ�һ����������N��2p�ܼ�����3�����ӣ��ﵽ�����ȶ��ṹ������N��һ�����ܷ�������һ�����ܴ�СΪ��N>O>C��
��2-�ϻ��������Ȼ�������ˮ�����γ���������Ӽ�����������������ˮ���Ի���ã�
��3������Ŀ�����������γ�����������Ҫ���ǣ���ԭ�ӹ�ƽ�棻�����ƽ�е�p��������ݼ۲���ӶԻ������ۣ�
A��SO2ΪV�ͣ�A��ȷ��
B��SO42-Ϊ�������壬����ƽ�棬B�����
C��H2SΪV�ͣ���H2S��Hԭ�Ӳ�����p����� C����
D��CS2Ϊֱ���ͣ���D����ȷ��
��ѡAD��
��4��������V�ĸ���Ϊ�� ![]() ��S�ĸ���Ϊ��
��S�ĸ���Ϊ��![]() ����ÿ����������2��VS����������Ϊ
����ÿ����������2��VS����������Ϊ![]() ������ͼ4�ɼ�������������Ϊ
������ͼ4�ɼ�������������Ϊ![]() ���������Ϊ
���������Ϊ![]() �����Ծ����ܶ�Ϊ
�����Ծ����ܶ�Ϊ![]()
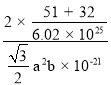 g��cm��3��
g��cm��3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ļ������ڻ���������Ӧ�÷dz��㷺.�Իش��������⣺
��1���������������������ҿ������������е��ʷ�Ӧ��
��֪��6Ag��s��+O3��g���T3Ag2O��s������H=��235kJ/mol��
2Ag2O��s���T4Ag��s��+O2��g������H=+60kJ/mol��
��Ӧ2O3��g��=3O2��g������H=___��
��2��SO2Cl2����������ҽҩƷ��Ⱦ�ϡ�������Լ���.��֪��SO2Cl2��g��![]() SO2��g��+Cl2��g����H=akJmol��1��300��ʱ�����Ϊ2L�ĺ����ܱ������г���0.20molSO2Cl2���ﵽƽ��ʱ�������к�0.1molSO2�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ___�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ___��
SO2��g��+Cl2��g����H=akJmol��1��300��ʱ�����Ϊ2L�ĺ����ܱ������г���0.20molSO2Cl2���ﵽƽ��ʱ�������к�0.1molSO2�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ___�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ___��
��3���ԣ�2���еķ�Ӧ����400�棬1.01��105Pa�����£����ݻ�Ϊ2L�ĺ����ܱ������г���һ������SO2Cl2��n��SO2����n��SO2Cl2����ʱ��ı仯������ͼ��ʾ��
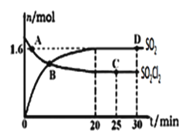
��0��20min��Ӧ��ƽ������v��SO2Cl2��=___����H___0(����<����>����������)��ԭ���ǣ�___��
������������ȷ����___��
A.A��v����SO2Cl2����v����SO2Cl2��
B.�ܶȺ�ƽ��Ħ�����������˵������ƽ��״̬
C.�����������䣬������ѹǿ��n��SO2����ͼ��D���ֵ��
D.�����������䣬500��ʱ��Ӧ��ƽ�⣬n��SO2����ͼ��D���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(Na2S2O3)����Ҫ�Ļ���ԭ�ϣ������������Լ�������Ļ�ԭ����������ˮ�����ȡ������ֽ⡣Na2S2O3��5H2O����ɫ�����壬������ˮ����ϡ��Һ��BaCl2��Һ����������ɡ���ҵ�ϳ����ú����ˮ����Na2S2O3��5H2O��ij��ѧ��ȤС����ʵ����������ͼ��ʾװ��(����װ�ü����ּг�װ������ȥ)ģ�����������̲�̽���仯ѧ���ʡ�
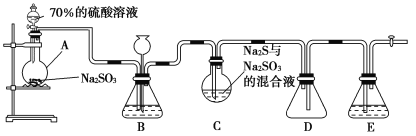
��ƿC�з������·�Ӧ��
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ��
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ��
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) ��
Na2S2O3(aq) ��
��.�Ʊ�Na2S2O3��5H2O
(1)����ҩƷ֮ǰ����еIJ�����_________��װ��D��������______________��װ��B������֮һ�ǹ۲�SO2���������ʣ����е��Լ����ѡ��________(����ĸ)��
A.����ˮ�������������� B.����Na2SO3��Һ
C.����NaHSO3��Һ D.����NaHCO3��Һ
(2)Ϊ��֤��������ƵIJ�����ʵ���в�����SO2���ܹ�����ԭ����_________�����ƵõĴֲ�Ʒ����ͨ��________������һ���ᴿ�õ���Na2S2O3��5H2O��
��.�ⶨ��Ʒ����
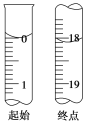
ȷ��ȡw g��Ʒ������������ˮ�ܽ⣬�Ե�����ָʾ������0.10 mol��L��1I2�ı���Һ�ζ�����Ӧԭ��Ϊ2S2O32-+I2=S4O62-+2I-��
(3)�ζ����յ�ʱ������______________���ζ���ʼ���յ�ʱI2�ı���ҺҺ��λ����ͼ��ʾ��������I2�ı���Һ�����Ϊ________mL����Ʒ�Ĵ���Ϊ________(��Na2S2O3��5H2O����Է�������ΪM���г���M��w��ʾ�ı���ʽ)��
��.̽��Na2S2O3�IJ��ֻ�ѧ����
(4)��������裩��
����һ��Na2S2O3��Na2SO4�Ľṹ���ƣ���ѧ����ҲӦ�����ƣ���ˣ�����ʱNa2S2O3��Һ��pH=7��
���������S�Ļ��ϼ��Ʋ�Na2S2O3���н�ǿ�Ļ�ԭ�ԡ�
����֤���裩����������Na2S2O3��Һ����������ʵ�飬�뽫ʵ�鲹��������
ʵ����� | ʵ����� ������ | �������(������ ����ʽ��ʾ) | |
����һ | ________ | ��ҺpH=8 | ________ |
����� | ����ˮ�� �������� Na2S2O3 ��Һ | ��ˮ��ɫ | ________ |
ʵ����ۣ�________________________________________��
��.Na2S2O3��Ӧ��
(5)Na2S2O3����Ʒ��Ϊ�����������׳������մ�������ѧ�ϳ����ڵζ�ʵ�顣Ϊ�ⶨijK2Cr2O7��Һ��Ũ�ȣ��о�С���ͬѧȷ��ȡ10.00 mL K2Cr2O7��Һ����ƿ�У��������KI���������ϡH2SO4���μӼ���ָʾ������0.10 mol��L��1 Na2S2O3����Һ�ζ����յ㣬����3��ƽ��ʵ����ƽ������Na2S2O3��Һ�����Ϊ30.00 mL����c(K2Cr2O7)=________mol��L��1��(��֪��Cr2O72-+6I-+14H��=2Cr3++3I2+7H2O��2S2O32-+I2=S4O62-+2I-)
��.̽���뷴˼
(6)Ϊ��֤��Ʒ�к���Na2SO3��Na2SO4����С�����������ʵ�鷽�����뽫ʵ�鷽������������
ȡ������Ʒ���ϡ��Һ��___________________(�����Լ���BaCl2��Һ��ϡHNO3��ϡH2SO4��ϡ���ᡢ����ˮ��ѡ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ���ἴ��˾ƥ������õĽ�����ʹҩ����ṹ��ͼ��ʾ���������������в���ȷ����( )
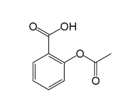
A.����ʽΪC9H8O4
B.��������������ˮ��������Ȼ�����Һ���Գ�����ɫ
C.1mol ����ˮ������������3molH2 ��Ӧ
D.1mol ����ˮ������������2molNaOH ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�顢������ؽ��۾���ȷ����
A | B | C | D | |
ʵ�� |
|
|
|
|
���� | Ʒ����ɫ | ����Թ���dz��ɫ���� | ���һ����Һʹ��̪����ɫ��Ϊ�ۺ�ɫ����30s����ԭ | ���ְ�ɫ���� |
���� | SO2 ��ǿǿ������ | �л����к�����ԭ�� | �ζ����յ� | Ksp(AgCl)��Ksp(AgI) |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a��b�����������������Ԫ�أ�c�ǵؿ��к�������Ԫ�أ�d��bͬ�壬e2+���ӵ�3d�������9�����ӡ��ش��������⣺
(1)c��d����Ԫ���γɵĻ�����ͳ�ƹ�ʯ����ͨ��______________����������ᾧ�κ����ε����ִ�����̬��c�ļ۵����Ų�ͼΪ______________________________��
(2)A��B�����������ֳ������л��A����CaCO3��Ӧ�������ڳ�����ˮ����B�����е�̼ԭ����Ŀ��A����ͬ�������Ʒ�Ӧ�ų����塣B�д��ڵĻ�ѧ��������______��
A.���Ӽ� B.���ۼ� C.������ D.���
A������̼ԭ�ӵĹ���ӻ�������___________��
(3)����>������<����գ�
��һ������ | �۵� |
b___d | dc2����___d���� |
(4)c��e����Ԫ�ؿ��γ�һ�ְ뵼����ϣ���ѧʽΪe2c���������������ڲ����ĸ�cԭ�ӣ�����cԭ��λ�����ĺͶ��㣬��þ�������____��eԭ�ӡ�
(5)��e2+�����ε�ˮ��Һ�м�������İ�ˮ���ɵõ�����ɫ����Һ��д�����������ӵĽṹ______________(Ҫ����λ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������ԲȦ�����ʼ京����ͬ��ijһԭ�ӣ��Ҹ�ԭ�ӵ����ʵ�����ͬ(��NAΪ�����ӵ�������ֵ)��
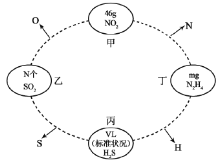
�ش��������⣺
(1)���е�NΪ___________�����е�VΪ___________��
(2)����NO2�Ͷ���N2H4�����ʵ���֮��Ϊ___________��
(3)����SO2�Ͷ���N2H4������֮��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����(As)��һЩ�����Ϳ�ɽ��ˮ�е���ȾԪ�أ�ʹ����������ȥ��ˮ�������Ч��ʩ֮һ���������̡�������������������Һ��һ��������ϣ�����ʹ���ַ�Ӧ���ɻ��һ����ĸ�Ч������X��������X�к���![]() ����ԭ����____________��
����ԭ����____________��
��2��H3AsO3��H3AsO4ˮ��Һ�к���ĸ����ֵķֲ�����(ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)��pH�Ĺ�ϵ�ֱ�����ͼ1����ͼ2��ʾ��
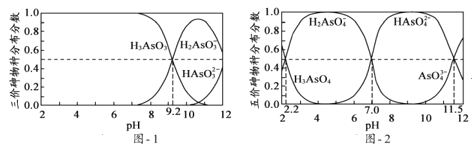
���Է�̪Ϊָʾ��(��ɫ��ΧpH 8.0��10.0)����NaOH��Һ��μ��뵽H3AsO3��Һ�У�����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӡ��ù�������Ҫ��Ӧ�����ӷ���ʽΪ____��
��H3AsO4��һ�����뷽��ʽH3AsO4![]() H2AsO4+H+�ĵ��볣��ΪKa1����pKa1=____(pKa1=-lgKa1)��
H2AsO4+H+�ĵ��볣��ΪKa1����pKa1=____(pKa1=-lgKa1)��
��3��25��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����______��
A��0.1mol/L CH3COONa��Һ��0.1mol/L HCl��Һ�������ϣ�c��Na+��=c��Cl-����c��CH3COO-����c��OH-��
B���������ʵ�����NaX������HX�Ļ����Һ��һ�����ڣ�c��Na+����c��X-��
C��0.1mol/L Na2CO3��Һ��0.1mol/L NaHCO3��Һ�������ϣ�2c��Na+��=3c��CO32-��+3c��HCO3-��+3c��H2CO3��
D��Na2C2O4��Һ��HCl��Һ�������ϣ�H2C2O4�Ƕ�Ԫ���ᣩ��2c��C2O42-��+c��HC2O4-��+c��OH-��+c��Cl-��=c��Na+��+c��H+��
��4������ͼʾ���Ӧ���������������______��
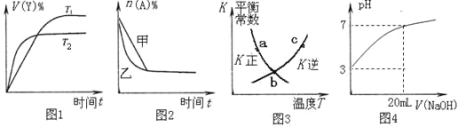
A��ͼ1��ʾ���淴Ӧ��2X(g) ![]() Y(g)��H��0���¶�T1��T2������
Y(g)��H��0���¶�T1��T2������
B��ͼ2��ʾѹǿ�Կ��淴Ӧ2A(g)+2B(g) ![]() 3C(g)+D(s)��Ӱ�죬��ѹǿ�ȼ�ѹǿ��
3C(g)+D(s)��Ӱ�죬��ѹǿ�ȼ�ѹǿ��
C��ͼ3��a��b��c������ֻ��b���Ѿ��ﵽ��ѧƽ��״̬
D��ͼ4����20 mL pH=3�Ĵ�����Һ�еμ�pH=11��NaOH��Һ������pH�仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʷ�ϱ���Ϊ������˴�������20 ����ʮ��������֮һ����ɼ���⻯ѧ�����¼�ʹ ���������ʶ��������β����Σ���ԡ�����β���е��������̼�⻯���������������ÿɲ� ��������Ⱦ��⻯ѧ����������ijЩ��Ӧ������ͼ��ʾ������˵������ȷ���ǣ� ��
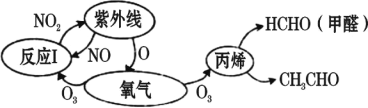
A.������һ�ֹ��ܽ������ɢ���ǿ���B.O2 �� O3 ����������ͬ��������
C.��Ӧ I ����������ԭ��ӦD.NO2 ��������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com