
【题目】下列实验、现象及相关结论均正确的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30s不复原 | 出现白色沉淀 |
结论 | SO2 有强强氧化性 | 有机物中含有溴原子 | 滴定达终点 | Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
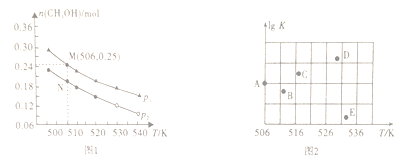
①该反应的△H_____0(填“>”、“<”或“=”),判断理由是_______________。
②M点时,CO的转化率为________。506K时该反应的平衡常数K=________(保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________。
④下列叙述能说明反应CO(g)+2H2(g) ![]() CH3OH(g)达到平衡状态的是________(填序号)。
CH3OH(g)达到平衡状态的是________(填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
D.有机物![]() 分子中所有碳原子不可能在同一个平面上
分子中所有碳原子不可能在同一个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系分别如图一、图二所示。
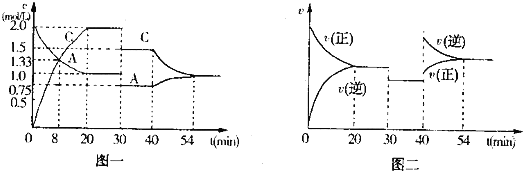
请回答下列问题:
(1)020min,A的平均反应速率为___mol/(Lmin);8min时,v(正)___v(逆)。(填“>”“=”或“<”)
(2)30min时改变的反应条件是___.
(3)40min时改变的条件是升高温度,则该反应的正反应为___(填“吸热”或“放热”)反应。
(4)能判断该反应是否达到化学平衡状态的依据是______(多项选择)。
a.容器内压强不变 b.混合气体中c(A)不变
c.v正(A)=v逆(B) d.c(A)=c(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子排布式为_________________。钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是______________,VO43-的立体构型为__________。
(2)2-巯基烟酸氧钒配合物(图1)是副作用较小的有效调节血糖的新型药物。
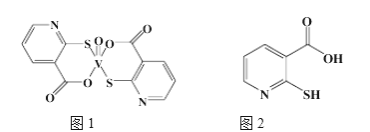
①该药物中N原子的杂化方式是____________,其所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是_________________________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
(4)某六方硫钒化合物晶体的晶胞如图3所示,图4为该晶胞的俯视图,该晶胞的密度为________________ g·cm-3(列出计算式即可)。
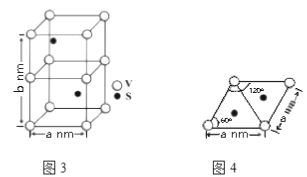
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断不正确的是
A.原HNO3溶液的物质的量浓度为2.24 mol·L-1
B.原溶液中投入铁粉的物质的量是0.2 mol
C.反应后溶液中c(Fe3+):c(Fe2+)=2:3
D.反应后的溶液还可以溶解铜粉4.48g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和![]() 在一定条件下制备
在一定条件下制备![]() 的反应为:
的反应为:![]() ,在体积为1L的恒容密闭容器中,充人
,在体积为1L的恒容密闭容器中,充人![]() 和
和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
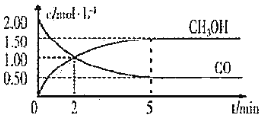
![]() 从反应开始至达到平衡,用氢气表示的平均反应速率
从反应开始至达到平衡,用氢气表示的平均反应速率![]() ______
______![]()
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母序号
填字母序号![]() 。
。
A.达到平衡时,CO的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前![]() 正
正![]() 逆
逆![]() ,2min后
,2min后![]() 正
正![]() 逆
逆![]()
![]() 该条件下反应的平衡常数
该条件下反应的平衡常数![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 含有氢原子数为0.4NA的CH3OH分子中含有的共价键数目为0.5NA
B. a g某气体含分子数为b,c g该气体在标准状况下体积为![]() L
L
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
D. 常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com