
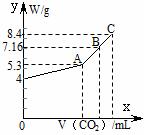
往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:
(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL(标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液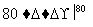 NaClO3溶液
NaClO3溶液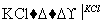 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
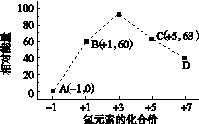
(4)一定条件下,在水溶液中1 mol Cl-、ClO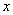 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学用下列装置制备并检验Cl2的性质:
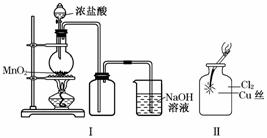
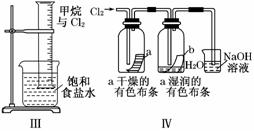
下列说法正确的是( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B.Ⅱ图中:生成蓝色的烟 C.Ⅲ图中:量筒中发生了加成反应
D.Ⅳ 图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
在离子浓度都为0.1 mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是 A.在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+
B.在含I—、SO32—、Br—的溶液中不断通入氯气:I—、Br—、SO32—
C.在含Fe3+、H+、NH4+的溶液中逐滴加入烧碱溶液:Fe3+、NH4+、H+
D.在含AlO2—、SO32—、OH—的溶液中逐滴加入硫酸氢钠溶液:OH—、AlO2—、SO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原
子的利用率为100%。下列反应类型中能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应
A.①②⑤ B.②⑤⑥ C.③④ D.只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子 数相等。 请回答下列问题:
(1)X元素的名称是________________
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________
(3)写出F的电子式______________________________
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式
________________________________, ;
B中含有的化学键是 ;
请举一例说明B的用途______________________________________________________
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| l | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(1)体系中发生反应的化学方程式是 ;
(2)该反应在O-5min时间内产物Z的平均反应速率: ;
(3)该反应在第 分钟(min)时达到平衡状态;
(4)若使该反应的速率增加,下列措施一定不能达到目的的是 。
A.升高温度 B.降低温度
C.使用催化剂 D.保持容器体积不变加入lmolx和2moly
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com