
(15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
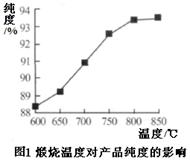
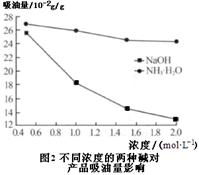
(1)将煤矸石中的矿物转化为氧化物,便于酸浸 (2分)
(2)提高浸取率,抑制Fe3+等水解 (2分)
烧杯、玻璃棒 (各1分)
(3)2.8≤pH<3.3;(2分) 继续加碱调pH至12.2,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤 (2分)
(4)加水恰好浸没滤渣,待滤尽后重复2~3次 (2分)
(5)800 (1分)
(6)用NaOH溶液,获得的氧化铁表面积小,吸油量低(2分)
解析试题分析:(1)将煤矸石焙烧2小时,反应充分,可将煤矸石中的矿物转化为氧化物,便于酸浸。
(2)酸浸后生成Fe2(SO4)3,所以过量H2SO4可以提高浸取率,抑制Fe3+等水解。
(3)根据表中数据,Fe3+完全沉淀时的pH为2.8,而Al3+开始沉淀时的pH为3.3,要使Fe3+完全转化为沉淀而不含杂质,调节pH的最佳范围是2.8≤pH<3.3;继续加碱调pH至12.2,Mg2+完全转化为Mg(OH)2沉淀,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤,可获取较纯净的硫酸镁晶体。
(4)滤渣水洗的操作是:加水恰好浸没滤渣,待滤尽后重复2~3次。
(5)根据图1曲线,800℃时产品的纯度达到较大值,再升温,纯度升高不大,所以煅烧时温度最好控制在800℃
(6)根据图2两条曲线可知:用NaOH溶液,获得的氧化铁表面积小,吸油量低。
考点:本题考查物质的制备、基本操作、图像的分析。


科目:高中化学 来源: 题型:填空题
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为 。
(2)用水洗涤时,如何证明S042-己除尽 。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 。
(4)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(7分)现有22g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与200mL含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐70g,求(要求写出计算过程)
(1)硫酸溶液的质量?
(2)生成的气体体积(标准状况)?
(3)硫酸物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现有镁条、铝粉、铜片、氧化铝、氧化铁、氯酸钾及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证铝、铁金属单质的还原性强弱。依据你设计的实验方案,回答下列问题:
(1)实验原理:(用化学方程式表示) ;实验中所需的化学仪器为 。
(2)引发实验的操作方法为: 。
(3)实验探究:取少量反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填能或否)说明固体混合物中无Fe2O3,并说明理由 (理由用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)铜与浓硫酸反应,实验装置如图所示。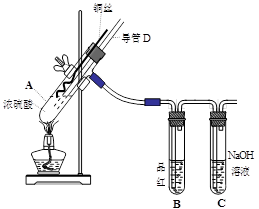
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|
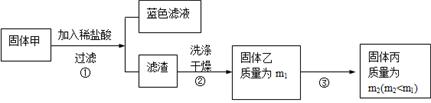 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有: 。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2: 。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为 。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。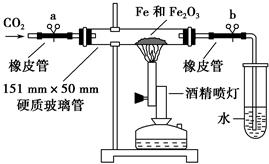
①按如图装置连接好仪器(暂不装入药品), 。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹, ,即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中的溶液上方,木条复燃。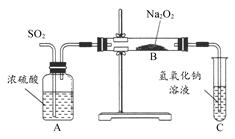
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3: 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案: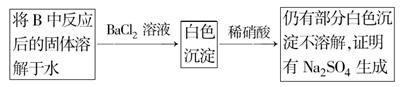
上述方案是否合理? 。请简要说明两点理由:① ;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:________。
(2)实验中,需加热至恒重的目的是________。
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3—=BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为________。
(2)实验中判断沉淀是否完全的方法是________。
方案三:按如下图所示装置进行实验: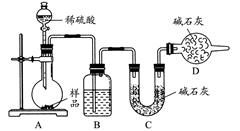
(1)D装置的作用是________。分液漏斗中________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90 g样品,实验后测得C装置增重8.80 g,则样品中Na2CO3的质量分数为________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷,该缺陷是________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知Fe2O3与H2反应会因温度不同而可能有Fe3O4生成。某化学兴趣小组在用H2还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X。为探究X的组成,他们进行了如下实验:
(1)甲同学认为黑色粉末X能被磁铁吸附,因此X是铁。但乙同学不同意他的结论,原因是___________________________。
(2)乙同学先将少量黑色粉末X加入装有足量硫酸铜溶液的烧杯中,振荡,固体部分溶解,有极少量红色物质析出,过滤;然后向滤渣中加入盐酸,再滴加几滴KSCN溶液,溶液出现红色。通过现象分析,丙同学得出X的组成是Fe和Fe3O4。
①滴加KSCN溶液的目的是_____________________。
②若将粉末X直接加入盐酸中,再加KSCN溶液,溶液不出现红色,则不出现红色的原因是(用离子方程式表示) _____________。
(3)丁同学的实验方案: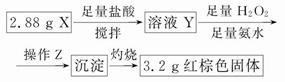
①操作Z是__________________。
②通过以上数据,得出2.88 g黑色粉末X中各成分的物质的量为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com