
【题目】下列有关有机物的叙述正确的是
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B. 高聚物的相对分子质量一定为单体相对分子质量的整数倍
C. ![]() 分子中只存在羧基、羟基两种官能团
分子中只存在羧基、羟基两种官能团
D. 煤的干馏,气化和液化都是物理变化
【答案】A
【解析】分析:A. 根据海水淡化的主要方法分析;
绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;
B缩聚物的相对分子质量不是单体相对分子质量的整数倍;
C. ![]() 是缩聚产物,分子中含有酯基;
是缩聚产物,分子中含有酯基;
D.煤的干馏指煤在隔绝空气条件下加强热使之分解的过程.
详解:A. 海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,所以A选项是正确的;
B.缩聚物的相对分子质量不是单体相对分子质量的整数倍,所以B选项是错误的;
C.![]() 是缩聚产物,分子中含有酯基,所以C是错误的;
是缩聚产物,分子中含有酯基,所以C是错误的;
D.煤的干馏指煤在隔绝空气条件下加强热使之分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,是化学变化,所以D选项是错误的。
所以A选项是正确的。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】用化学反应原理研究氮及其化合物意义重大。请回答下列问题:
(1)已知: N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_______。
(2)T1温度时,在容积为2 L 的恒容密闭容器中发生反应: 2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
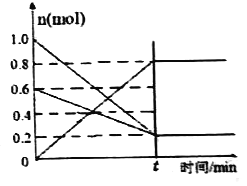
①下列说法能表明该反应已达到平衡状态的是______(填序号)。
A.混合气体的密度不变 B.混合气体的颜色不变
C. k正、k逆不变 D.2v正(O2)= v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系是K=_______。
③T1温度时,化学平衡常数K=______。将容器的温度改变为T2时,若k正=k逆 ,则T2___T1 (填“>”、“<”或“=”)。
(3) 亚硝酸是氮元素重要的含氧酸之一。25℃,测得amol/LHNO2稀溶液的pH=b,该温度下HNO2电离平衡常数的精确计算表达式为K=______(用含a、b的代数式表示)。将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合后,测得溶液pH=7,则溶液中![]() =_____(用含a 的代数式表示)。
=_____(用含a 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管A中先加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸,最后加入2 mL冰醋酸,按下图装置进行实验,并将产生的蒸气经导管通到试管B中饱和碳酸钠溶液的液面上。请回答下列问题:

(1)浓硫酸的作用是__________________________________________。
(2)试管B中观察到的现象是_____________________________。
(3)若试管B中的饱和碳酸钠溶液用冷水代替,实验结束后不能闻到香味的可能原因是________________________________________________________________________。
(4)试管B中的饱和碳酸钠溶液的作用是__________________________________。
(5)通入蒸气的导管不能插入试管B中液面下的原因是_______________________________________。
(6)通入蒸气常选用长导管的目的是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的1,2-二氯乙烷,可采用的方法是( )
A. 乙烯和HCl加成 B. 乙烷和Cl2按1∶2的体积比在光照条件下反应
C. 乙烯和氯气加成 D. 乙烯先与HCl加成,再与等物质的量的氯气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物元素组成包括 C、H、O、N、P 等,该化合物的功能不可能是
A. 参与细胞膜的构成
B. 催化代谢反应
C. 细胞的储能物质
D. 携带遗传信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大。X元素原子的半径最小。Z、W在周期表中处于邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层子数的2倍。请回答:
(1)Z2的电子式为___________,YW2的结构式为____________。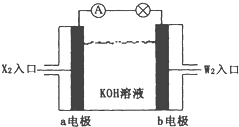
(2)将X2、W2按上图所示通入某燃料电池中,其中,b电极的电极反应式为__________________。若有16gW2参加反应,转移的电子数是____________。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐_______(化学式),与足量的NaOH溶液在加热条件下反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铝榴石颜色深红,是宝石界中最常见的石榴子石,其化学成分为Fe2Al2( SiO4)3O铁铝榴石中所含元系不属于短周期元素的是
A.AlB.FeC.SiD.O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com