
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B. 高聚物的相对分子质量一定为单体相对分子质量的整数倍
C. ![]() 分子中只存在羧基、羟基两种官能团
分子中只存在羧基、羟基两种官能团
D. 煤的干馏,气化和液化都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池,请利用反应“Cu +2Ag+![]() 2Ag + Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
2Ag + Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
①该电池的负极材料是 ;
②若导线上转移电子2.5mol,则正极生成银 克。
(2)现有A、B、C、D四种金属片,①把A、B用导线连接后同时浸入稀硫酸溶液中,A 上有气泡产生;②把C、D用导线连接后同时侵入稀硫酸溶液中,D发生还原反应;③把 A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C。根据上述情况,回答下列向题
①在①中,金属片 发生氧化反应
②在②中,金属片 作负极,
③如果把B、D用导线连接后同时侵入稀硫酸溶液,则金属片 上有气泡产生。
④上述四种金属的活动顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G[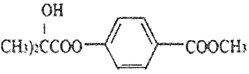 ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下:
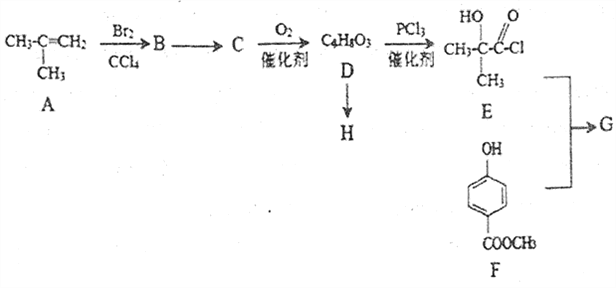
已知:RCOOH  RCOCl
RCOCl
请回答下列问题:
(1)A的同分异构体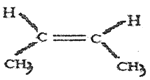 名称是_______。
名称是_______。
(2) B→C 的反应条件为_________,D→E的反应类型是________。
(3)D在浓硫酸加热的条件下会生成一种含六元环的化合物,该化合物的结构简式为______。
(4)H 是一种高聚酯,D→H 的化学方程式为________________。
(5)下列关于化合物D 和G 的说法错误的是_______。
A.在一定条件下G 能与HBr 发生取代反应
B.1molG 与NaOH 溶液加热最多消耗2molNaOH
C.D 的分子中只有一个手性碳原子
D.与D具有相同的官能团的同分异构体还有3种
(6)符合下列要求的F 的同分异构体共有______种
①苯环上有三个取代基 ②能发生银镜反应 ③1mol 物质能与2mo1Na2CO3反应
请写出其中能与足量浓溴水反应,所得产物的苯环上不存在氢原子的F 的同分异构体结构简式__________(任写一种)
(7)已知酚羟基不易与羧酸发生酯化反应,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯(![]() )的合成路线(其它试剂任选)。___________
)的合成路线(其它试剂任选)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)1-丁烯与溴水的反应 ______________________;
(2)乙醇与乙酸的反应____________________;
(3)用苯制溴苯的反应_________________________;
(4)乙醇的催化氧化_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。下图路线中的①-③、Ⅰ-Ⅲ分别是工业生产硝酸和雷电高能固氮过程中硝酸的生成途径。回答下列问题: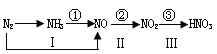
(1)雷电高能固氮生产硝酸的三个反应中,是否均为氧化还原反应?_______。
(2)图中途径I、①和②对应的三个反应中,常温下就能进行的是途径________。
(3)途径③对应的反应为NO2+H2O—HNO3+NO(未配平),该反应过程中氧化产物和还原产物的物质的量之比为__________________。
(4)硝酸必须保存于棕色瓶里并置于阴凉处的原因是____________________;可用铝质或铁质容器盛放冷的浓硝酸的原因是_____________________。
(5)硝酸的用途之一是与氨气反应制硝酸铵,其化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)固体可分为晶体、非晶体和准晶体三大类,可通过________________方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为_______________。
(2)PCl3的立体构型为______________,中心原子的杂化轨道类型_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是___________________。
②B、C、N、O三种元素第一电离能由小到大的顺序为___________。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:____________。
(4)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
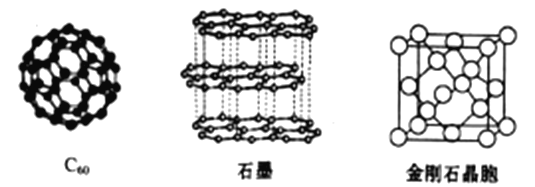
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的________共价键,而石墨层内的C-C间存在_________键。
②金刚石晶胞含有___________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率__________(不要求计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com