
【题目】为了使Al2(SO4)3中的Al3+完全沉淀,适宜用到的试剂是
A.NaOH溶液B.Ba(OH)2溶液C.氨水D.BaCl2溶液
科目:高中化学 来源: 题型:
【题目】某种化合物元素组成包括 C、H、O、N、P 等,该化合物的功能不可能是
A. 参与细胞膜的构成
B. 催化代谢反应
C. 细胞的储能物质
D. 携带遗传信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的两随时间的变化曲线如图所示,据此回答:

(1)该反应的化学方程式为 。
(2)从开始至2min,Z的平均反应速率为 mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度
B.减小物质X的物质的量
C.减小压强
D.增加物质Z的物质的量.
E.加入某种催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是

A. 按系统命名法,上图有机物的命名为2,3-二甲基-3-乙基戊烷
B. 结构为…-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单元链节是乙炔
C. 总物质的量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变
D.  化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应
化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸 ![]() 发生酯化反应的产物.
发生酯化反应的产物.
(1)甲一定含有的官能团的名称是 .
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是: .
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(任写2种结构简式)、 .
(4)已知:R﹣CH2﹣COOH ![]()
![]() R﹣ONa
R﹣ONa ![]() R﹣O﹣R′(R﹣、R′﹣代表烃基) 菠萝酯的合成路线如下:
R﹣O﹣R′(R﹣、R′﹣代表烃基) 菠萝酯的合成路线如下: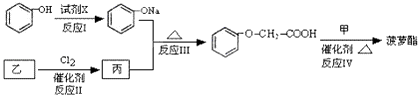
①试剂X不可选用的是(选填字母) .
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是 , 反应Ⅱ的反应类型是 .
③反应Ⅳ的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是
A.称量时,将固体NaOH直接放在天平左盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、O、Si、S、Fe是重要的化学元素,在中学化学中对它们的单质和化合物的研究颇多。
(1)C、O、Si三种元素第一电离能由大到小的顺序是_______________________。
(2)CS2是重要的溶剂,CS2中C原子的杂化方式为_____________,其空间构型为_______________。
(3)基态Fe原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状为_______________。
(4)晶胞推导有助于我们理解晶体结构。
①将NaC1晶胞(如右图)中的所有C1-去掉,并将Na+全部换成Si原子,再在间隔的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞,若再在每两个距离最近的Si原子中心连线的中点处增添一个O原子,便构成了SiO2晶胞。由此可推算SiO2晶胞中有______个Si原子,______个O原子。
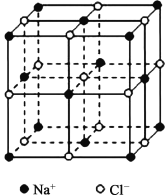
②简述利用NaC1晶胞推导出CsC1晶胞的方法:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g)![]() CH3OH(g) ΔH。
CH3OH(g) ΔH。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
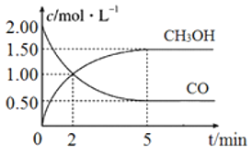
①从反应开始到2 min,用氢气表示的平均反应速率v(H2)=__________。
②下列说法正确的是______________(填字母序号)。
A.达到平衡时,H2的转化率为75%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.35molCO气体,则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)工业上另一种合成甲醇的方法是利用CO2和H2,己知:CH3OH、H2的燃烧热(ΔH)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是______________________。
(4)CH3OH(l)作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com