
【题目】实验室制备下列气体时,只能用排水法收集的是( )
A.H2B.SO2C.NO2D.NO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.放热过程均发生化学反应
B.周期表中第13列元素均为金属元素
C.在过渡元素中可寻找催化剂和耐高温、耐腐蚀的合金材料
D.合成氨反应达到平衡时,正、逆反应速率相等且均为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支25 mL的酸式滴定管中盛入0.lmol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1 NaOH 溶液进行中和.则所需 NaOH 溶液的体积
A. 大于20 mL B. 小于20 mL C. 等于20 mL D. 等于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是( )
A. 用容量瓶配制溶液时,若加水超过刻度线,立即用滴定管吸出多余液体
B. 酸式滴定管装标准液前,必须先用该溶液润洗
C. 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
D. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”,常用于催化剂和新型电池。钒(V)在溶液中主要以VO43-(黄色)、VO2+(浅黄色)、VO2+ (蓝色)、V3+(绿色)、V2+(紫色)等形式存在。回答下列问题:
(1)已知:4Al(s)+3O2(g)=2Al2O3(s) △H1 4V(s)+5O2(g)=2V2O5(s) △H2
写出V2O5与Al 反应制备金属钒的热化学方程式__________________。(反应热用△H1、△H2表示)
(2) V2O5具有强氧化性,溶于浓盐酸可以得到蓝色溶液(含有VO2+),试写出V2O5与浓盐酸
反应的化学反应方程式:_________________________________。
(3)VO43-和V2O74-在pH≥13的溶液中可相互转化。室温下,1.0mol·L-1的Na3VO4溶液中c(VO43-)随c(H+)的变化如图所示。溶液中c(H+)增大,VO43-的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算该转化反应的平衡常数的数值为________。
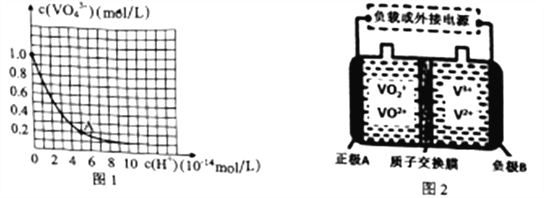
(4)全钒液流电池是一种优良的新型蓄电储能设备,其工作原理如图2所示:
①放电过程中,A电极的反应式为___________________。
②充电过程中,B电极附近溶液颜色变化为___________________。
③若该电池放电时的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用率为______________(写出表达式,不必计算出结果。已知:电量Q=It,t为时间/秒;电解时Q=znF,z为每摩尔物质得失电子摩尔数,n为物质的量,法拉弟常数F=96500C/mol,电流利用效率=![]() ×100%)
×100%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com