
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.H+、Ca2+、CO32-、Cl-B.Na+、K+、OH-、Cl-
C.Na+、Mg2+、SO42-、OH-D.Cu2+、Ba2+、Cl-、SO42-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g)+aQ(g),2 min后达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
2Z(g)+aQ(g),2 min后达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,下列叙述错误的是( )
A. a的值为2 B. 平衡时X的浓度为0.2 mol·L-1
C. Y的转化率为60% D. 反应速率v(Y)=0.3 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将ag铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL(标准状况);
方案二:将a/10g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.020 00 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:__________________________
![]() KMnO4+
KMnO4+![]() FeSO4+
FeSO4+![]() H2SO4===
H2SO4===![]() Fe2(SO4)3+
Fe2(SO4)3+![]() MnSO4+
MnSO4+![]() K2SO4+
K2SO4+![]() H2O
H2O
(2)在滴定实验中不能选择________式滴定管,理由是______________;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为________和________;
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一________(填“准确”、“不准确”或“不一定准确”),理由是____________;
②方案二________(填“准确”、“不准确”或“不一定准确”),理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
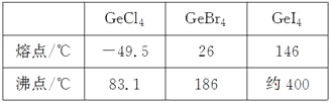
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。
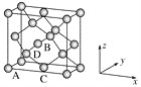
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是__________;实验室在配制FeSO4溶液时常加入____以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化__。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是______________________。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是_____________________________。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为_。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________ (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:![]()
B. 甲烷分子的比例模型: ![]()
C. COCl2的结构式为:![]()
D. H2O2的电子式为:H+[ ![]() ]2-H+
]2-H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com