
【题目】下列物质中属于镁条在空气中燃烧产物的是( )
①MgCO3 ②Mg(OH)2 ③MgO④C ⑤Mg3N2 ⑥CO
A.①②③
B.⑤⑥
C.③④⑤
D.②③
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是( )
A. H3PO2中磷元素的化合价为+1 B. H3PO2的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
C. H3PO2被AgNO3氧化成了H3PO4 D. NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是______;
②写出溶液中加入过量的稀硫酸反应的离子方程式______;
(2)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为____。
(3)酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式________________。
②取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和CO均为燃煤烟气中的主要污染物,对二者的治理备受瞩目。
请回答下列问题:
(1)下列事实中,不能用于比较硫元素和碳元素非金属性强弱的是___________(填选项字母)。
A.SO2能使酸性KMnO4溶液褪色而CO2不能
B.相同条件下,硫酸的酸性强于碳酸
C.CS2中硫元素显-2价
D.相同条件下,SO3的沸点高于CO2
(2)有人设计通过硫循环完成二者的综合处理,原理为
i.2CO(g) +SO2 (g)![]() S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
ii.S(l) + 2H2O(g)![]() 2H2(g) + SO2(g) △H2 =-45.4 kJ·mol-1
2H2(g) + SO2(g) △H2 =-45.4 kJ·mol-1
1 mol CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________。
(3)T℃,向5L恒容密闭容器中充入2 mol CO和1 mol SO2,发生反应i。10min达到平衡时,测得S(l)的物质的量为0.8mol。
①010 min内,用CO表示该反应速率v(CO)=____________________。
②反应的平衡常数为______________________。
(4)起始向密闭容器中充入一定量的S(1)和H2O(g),发生反应ii。H2O(g)的平衡转化率与温度(T)和压强(p)的关系如图所示。

①M、P两点的平衡转化率:a(M)___________a(P)(填“>”“<”或“=”),理由为_____________________。
②N、P两点的平衡常数:K(N)___________K(P)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花中可提取一种简写为HIn的有机物,在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。HIn(aq,红色)![]() H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、 (3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、 (3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
A. (1)(4)(5) B. (2)(6) C. (1)(3)(4) D. (5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
A. 混合物中NaHCO3和Na2O2物质的量一定相等
B. 容器中肯定有0.5molO2
C. 反应后,容器中的固体只有Na2CO3
D. 反应后,容器中一定没有H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在不同的电解质溶液中可以组成不同的电池.
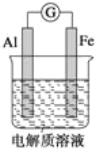
(1)当电解质溶液为稀硫酸时,Fe 电极是_____(填“正”或“负”)极,其电极反应式为______.
(2)当电解质溶液为 NaOH 溶液时,Al 电极是______(填“正”或“负”)极,其电极反应式为______.
(3)若把铝改为锌,电解质溶液为浓硝酸,则 Fe 电极的电极反应式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
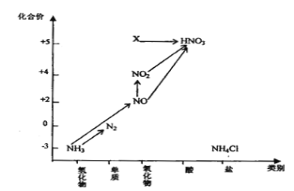
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为________。
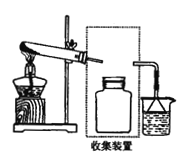
(2)若要收集一瓶氨气,请将下列装置补充完整,在图中虚线框内画出连接图____________。
(3)下列试剂可用于干燥NH3的是____________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为_____________。
(5)图中X转化为HNO3的化学方程式为:_______________________________。
(6)若要实现NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com