
【题目】次磷酸(H3PO2)是一种具有强还原性的一元弱酸,工业上常利用H3PO2和AgNO3溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中不正确的是( )
A. H3PO2中磷元素的化合价为+1 B. H3PO2的电离方程式为H3PO2![]() H++H2PO2-
H++H2PO2-
C. H3PO2被AgNO3氧化成了H3PO4 D. NaH2PO2、NaH2PO4、Na2HPO4均为酸式盐
【答案】D
【解析】
A.H3PO2中H为+1价,O为-2价,则磷元素的化合价为+1,选项A正确;B.次磷酸是一元弱酸,一元弱酸部分电离出一个氢离子,所以H3PO2的电离方程式为H3PO2H++H2 PO2-,选项B正确;C.H3PO2中,氢元素为+1价,氧元素为-2价,依据化合价代数和为0,磷化合价为+1价,该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,选项C正确;D.H3PO2是一元酸,NaH2PO2是正盐,NaH2PO4、Na2HPO4均为酸式盐,选项D错误。答案选D。


科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin),试求:(1)x的值_______;
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin),试求:(1)x的值_______;
(2)5min时A的浓度_______;
(3)此5min内B的转化率_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,HCN中C的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨在水中第一步电离反应的平衡常数值为___________________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为__________________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为__________________。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是______________________________。联氨可用于处理高压锅炉水中的氧气,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)实验室模拟合成氨和氨催化氧化的流程如下:


(1)N元素在周期表中位置_______________________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合、干燥,还有______________作用。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,锥形瓶中还可观察到的现象是_______________________________________。
(4)写出乙装置中氨氧化的化学方程式:__________________________________________。
(二)实验室探究铜与硝酸反应的相关问题,按下图所示装置进行实验。

请回答下列问题:
(5)装置甲中盛放浓硝酸的仪器A的名称是_______________________。
(6)实验过程中,装置丙中出现的现象是:________________________________________。
(7)装置丙中的试管内发生反应的离子方程式为:__________________________________。
取下装置丙中的试管D,在其中滴加FeSO4溶液,再滴加KSCN溶液,溶液变为______________色。
(8)待反应停止后,Cu片有剩余,取下B,加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,离子方程式为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质充分反应后,最终既有沉淀又有气体生成的是
①少量Na2O2投入Ca(HCO3)2溶液中
②过量Ba(OH)2溶液和NH4HSO4溶液混合加热
③AlCl3溶液与NaHCO3溶液混合
④FeCl3溶液与NaHS溶液混合
A. ②③④ B. ①② C. ①③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
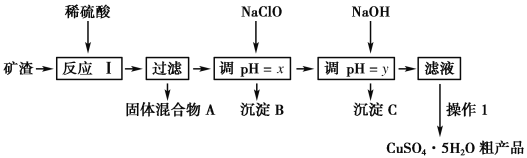
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中属于镁条在空气中燃烧产物的是( )
①MgCO3 ②Mg(OH)2 ③MgO④C ⑤Mg3N2 ⑥CO
A.①②③
B.⑤⑥
C.③④⑤
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500 ℃,10 mol SO2和5 mol O2反应
乙:500 ℃,V2O5作催化剂,10 mol SO2和5 mol O2反应
丙:450 ℃,8 mol SO2和5 mol O2反应
丁:500 ℃,8 mol SO2和5 mol O2反应
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁
C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com