
| A. | 化石燃料属于可再生能源,不影响可持续发展 | |
| B. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 氢气燃烧热高,其燃烧产物是水,是一种理想的清洁燃料 |
分析 A.化石燃料属于不可再生能源,大量使用,影响可持续发展;
B.太阳能、水能、风能都是清洁能源;
C.煤的气化是把煤炼成焦炭,再将焦炭在高温下与水蒸气反应,得到CO和H2;
D.氢气的燃烧产物是水,属于清洁能源.
解答 解:A.化石燃料是不可再生能源,在地球上蕴藏量是有限的,大量使用,影响可持续发展,故A错误;
B.太阳能、水能、风能都是清洁能源,煤、石油等化石燃料燃烧产生大量的污染物,不利用环境保护,故B正确;
C.煤的气化是把煤炼成焦炭,再将焦炭在高温下与水蒸气反应,得到CO和H2;可以减少二氧化硫等有毒气体的排放,实现了煤的高效、清洁利用,故C正确;
D.氢气的燃烧产物是水,无污染,属于清洁能源,故D正确.
故选A.
点评 本题考查了化石燃料对环境的污染与新能源的开发,把握“节能减排”,是解题关键,培养学生树立保护环境的观念,难度不大.


科目:高中化学 来源: 题型:填空题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为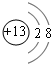 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Ca2+、Cl-、NO3- | B. | Na+、AlO2-、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | Fe3+、Al3+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


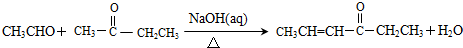
 ,其反应类型是加成反应.
,其反应类型是加成反应.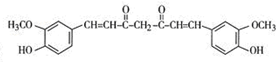 .
.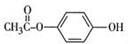 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com