
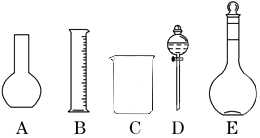
分析 (1)根据配制一定物质的量浓度的溶液的操作步骤选择使用的仪器;
(2)依据容量瓶构造解答;
(3)配制一定物质的量浓度溶液的步骤:计算、称量、稀释、冷却、移液、定容、摇匀、装瓶等,据此排序;
(4)依据m=CVM计算解答;
(5)依据浓硫酸稀释的正确操作解答;
(6)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制溶液的操作步骤:首先计算出需要的溶质的质量(浓硫酸体积),然后天平称量(量筒量取),后放入烧杯中溶解(稀释),同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.在此过程中用到的仪器有:天平、量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,还缺少的仪器有:胶头滴管、玻璃棒,不需要的是:平底烧瓶和分液漏斗;
故答案为:A、D;玻璃棒、胶头滴管;
(2)容量瓶为配制一定物质的量浓度溶液专用仪器,容量瓶上标有以下温度、容量、刻度线;
故选:①③⑥;
(3)配制一定物质的量浓度溶液的步骤:计算、称量、稀释、冷却、移液、定容、摇匀、装瓶等,所以正确的顺序为:BDAFEC;
故答案为:BDAFEC;
(4)配制0.2mol/L NaOH溶液500mL需 NaOH固体的质量为:0.2mol/L×40g/mol×0.5L=4.0g;
故答案为:4.0;
(5)浓硫酸稀释产生大量的热,稀释的正确操作为:将浓硫酸沿着烧杯壁缓缓注入水中,同时不断用玻璃棒搅拌;
故答案为:将浓硫酸沿着烧杯壁缓缓注入水中,同时不断用玻璃棒搅拌;
(6)A.用量筒量取浓硫酸时,仰视量筒的刻度,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高,故A不选;
B.容量瓶未干燥即用来配制溶液,对溶液体积和物质的量不产生影响,溶液浓度不变,故B不选;
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容,冷却后溶液体积偏小,溶液浓度偏高,故C不选;
D.往容量瓶转移时,有少量液体溅出,导致溶质的物质的量偏小,溶液浓度偏低,故D选;
E.在容量瓶中定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故E不选;
F.烧杯未进行洗涤,导致溶质的物质的量偏小,溶液浓度偏低,故F选;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故G选;
故选:BFG.
点评 本题考查了配制一定物质的量浓度的溶液的方法,熟悉配制过程是解题关键,注意误差分析的方法和技巧,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 醋酸浓度(mol•L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.
腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题.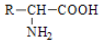 .腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质.
.腐乳虽好但不能作为主食,原因在于腐乳所含的糖类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该同学的实验目的是分离氯化钠、氯化钙 | |
| B. | 上图括号内的操作步骤均为加热蒸发 | |
| C. | 按此实验方案可得到较纯净的NaCl固体 | |
| D. | 按此实验方案可得到较纯净的CaCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com