
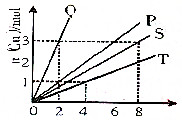
 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、在标准状况下,22.4LH2O中含有氢原子的个数为2NA |
| B、24gMg变为Mg2+时失去的电子数为2NA |
| C、常温下,32gO2中含有氧原子的个数为2NA |
| D、1L1mol/L NaCl溶液中含有钠离子的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液在电流作用下电离成Na+与Cl- |
| B、胶体就是分散质的微粒直径在1 nm~100 nm之间 |
| C、导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
| D、离子反应就是反应物全部以离子的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当0.10mol?L-1醋酸溶液pH=3.0时达到电离平衡状态 |
| B、0.10mol?L-1醋酸溶液和0.0010mol?L-1醋酸溶液的c(H+)之比为100:1 |
| C、0.10mol?L-1醋酸钠溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、0.1 mol/L NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.5 mol?l -1 |
| B、4.5 mol?l -1 |
| C、7.0 mol?l -1 |
| D、9.0 mol?l -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A处上升,B处下降 |
| B、A、B两处都下降 |
| C、A处下降,B处上升 |
| D、A、B两处都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B、溶液中导电能力的强弱主要与溶液中的离子浓度大小和离子所带电荷数有关 |
| C、强弱电解质的本质区别是溶液导电能力的强弱 |
| D、强电解质的溶液中只有离子,没有分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com