
| A. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| B. | 分液操作时,静置分层后要先放出分液漏斗中下层液体,再倒出上层液体 | |
| C. | 分液操作时,选择的萃取剂的密度必须比水大 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端靠在试管内壁 |
分析 A.蒸发皿可直接加热;
B.分液时避免上下层液体混合;
C.分液与溶解性有关,与密度无关;
D.用胶头滴管向试管滴加液体时,应悬空正放.
解答 解:A.蒸发皿可直接加热,不需要垫石棉网加热,故A错误;
B.分液时避免上下层液体混合,则分层后要先放出分液漏斗中下层液体,再倒出上层液体,故B正确;
C.分液与溶解性有关,与密度无关,不需要考虑萃取剂的密度,故C错误;
D.用胶头滴管向试管滴加液体时,应悬空正放,防止污染试剂,不能滴管尖端靠在试管内壁,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | S2-的结构示意图: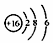 | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式 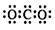 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量是32 g | B. | 体积是44.8 L | ||
| C. | 分子数是1.204×1024 | D. | 原子数是2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn2+的还原性弱于H2O2 | |
| B. | MnO4-是氧化剂,O2是氧化产物 | |
| C. | 生成lmol O2时,转移4 mol电子 | |
| D. | 离子方程式中按物质顺序的化学计量数是2、5、6、2、5、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 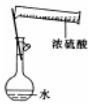 配制一定物质的量浓度的稀硫酸 | B. | 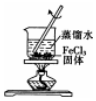 制取少量的Fe(OH)3胶体 | ||
| C. | 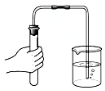 检查气密性 | D. | 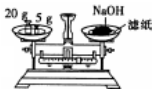 称量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶使用前经蒸馏水清洗后没有干燥 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 俯视确定凹液面与刻度线相切 | |
| D. | 用敞口容器称量NaOH且时间过长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com