
【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+ | Cu2+ | Ag+ | |
Cl- | 溶 | 溶 | 不 |
CO32- | 不 | 不 | 不 |
SO42- | 不 | 溶 | 微 |
S2- | 溶 | 不 | 不 |
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。
【答案】 CuSO4 AgNO3 BaCl2 AgCl Ag++Cl-![]() AgCl↓ 硫酸钠
AgCl↓ 硫酸钠
【解析】本题考查物质的推断和离子的检验,(1)根据离子是否大量共存,推断物质中含有AgNO3、BaCl2,则另一种物质为CuSO4,X盐溶液呈蓝色,说明X为CuSO4,加入盐酸,只有Y中出现白色沉淀,说明Y是AgNO3,Z为BaCl2;(2)①因为是沉淀是依次沉淀出来,通过表格,Ag+沉淀出来,用Cl-,Ba2+沉淀出来用SO42-,因此先加盐酸除去Ag+,沉淀1为AgCl;②反应的离子反应方程式为Ag++Cl-=AgCl↓;③溶液+B除去的Ba2+,C为Na2S,且它与B的阳离子相同,因此B为Na2SO4。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的取用说法不正确的是( )
A.胶头滴管可用来取用少量液体试剂B.无毒的固体试剂可用手直接取用
C.多取的钠可放回原试剂瓶中D.取用固体试剂时,可用药匙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述中,正确的是
A.酶的催化效率总是高于无机催化剂
B.一个酶分子只起一次作用
C.酶催化反应能放出更多的能量
D.催化蛋白质水解的酶的化学本质是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热 42g NaHCO3 和 Na2CO3 固体混合物,至没有气体放出时,剩余的固体质量是 35.8 g。那么原固体混合物中Na 2CO3 的质量是
A. 25.2g B. 16.8 g C. 10.6 g D. 24.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
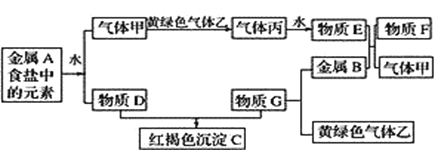
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com