
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,可由下列反应制得:2Fe(OH)3+3Cl2+10KO ![]() 2K2FeO4+6KCl+8H2O下列关于该反应说法正确的是( )
2K2FeO4+6KCl+8H2O下列关于该反应说法正确的是( )
A.KOH是氧化剂
B.Cl2发生还原反应
C.KFeO4是氧化产物
D.生成1mol K2FeO4转移6mol的电子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:______。
H2PO2-+Ag+ =PO43-+Ag+ 。
由工业白磷(含少量砷、铁、镁等)制备髙纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

(2)关于除砷条件的说法合理的是_______(填字母)。
a. 75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不宜过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
(3)硝酸氧化除砷时被还原为NO,氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越____(填“多”或“少”)。
(4)某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是__________________。
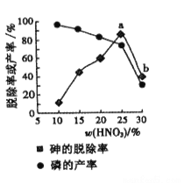
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.3mol单质Fe完全转变为Fe3O4 , 失去8NA个电子
B.常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA
C.78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA
D.标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , Na+ , Fe3+ , Mg2+ , Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( ) 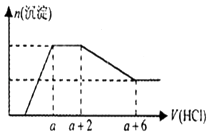
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为1:1
D.原溶液中一定含有的离子是OH﹣ , CO32﹣ , SiO32﹣ , AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室用加热氯化铵固体制取氨气
B.漂白粉属于混合物,液氯属于纯净物
C.醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物
D.煤的气化与液化均属于化学变化,煤的干馏属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素性质的叙述正确的是
A.质子数相同的微粒之间一定互称同位素
B.I A族与ⅦA族元素间形成的化合物一定是离子化合物
C.同主族元素的简单阴离子半径越大,其单质氧化性越弱
D.同周期金属元素的化合价越高,其氢氧化物的碱性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其主要成分的化学式相对应的是
A. 铝热剂-A1 B. 酒精-CH3COOH C. 纯碱一Na2CO3 D. 葡萄糖-C12H22O11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1L pH=l的硫酸溶液中含有的H+数目为0.2NA
B.1 mol羟基与l mol氢氧根离子所含质子数均为9NA
C.14 g由N2与CO组成的混合气体中含有的原子数目为2NA
D.标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常用来固定房门的“门吸”,它由磁铁和金属块两部分组成。该金属块能被磁铁所吸引,是因为可能含有以下材料中的
A. 银 B. 铁 C. 铝 D. 锌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com