
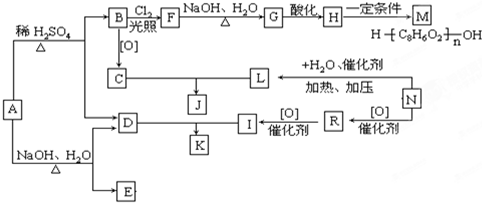

| NaOH、H2O |
| △ |
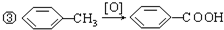
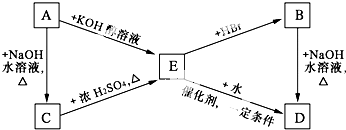
 ,C是
,C是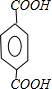 ,B与氯气光照下取代生成F,则F为
,B与氯气光照下取代生成F,则F为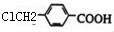 ,F在氢氧化钠水溶液中发水解反应生成G,G酸化生成H,则G为
,F在氢氧化钠水溶液中发水解反应生成G,G酸化生成H,则G为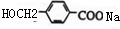 ,H为
,H为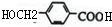 ;C与L按1:2反应生成J,则J为
;C与L按1:2反应生成J,则J为 ,J和K互为同分异构体,又D与I生成K,I由CH2=CH22步氧化生成,所以I为CH3COOH,则D为
,J和K互为同分异构体,又D与I生成K,I由CH2=CH22步氧化生成,所以I为CH3COOH,则D为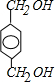 ,K为
,K为 ,A为
,A为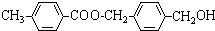 ,据此分析解答;
,据此分析解答; ,C是
,C是 ,B与氯气光照下取代生成F,则F为
,B与氯气光照下取代生成F,则F为 ,F在氢氧化钠水溶液中发水解反应生成G,G酸化生成H,则G为
,F在氢氧化钠水溶液中发水解反应生成G,G酸化生成H,则G为 ,H为
,H为 ;C与L按1:2反应生成J,则J为
;C与L按1:2反应生成J,则J为 ,J和K互为同分异构体,又D与I生成K,I由CH2=CH22步氧化生成,所以I为CH3COOH,则D为
,J和K互为同分异构体,又D与I生成K,I由CH2=CH22步氧化生成,所以I为CH3COOH,则D为 ,K为
,K为 ,A为
,A为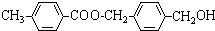 ,
, 名称为对甲基苯甲酸,J为
名称为对甲基苯甲酸,J为 名称对苯二甲酸二乙酯,故答案为:对甲基苯甲酸;对苯二甲酸二乙酯;
名称对苯二甲酸二乙酯,故答案为:对甲基苯甲酸;对苯二甲酸二乙酯; ,含有的所有官能团的名称为羧基和卤素原子,故答案为:羧基和卤素原子;
,含有的所有官能团的名称为羧基和卤素原子,故答案为:羧基和卤素原子;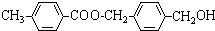 ;故答案为:
;故答案为: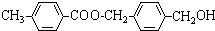 ;
; +2CH3COOH
+2CH3COOH| 浓硫酸 |
| △ |
 +2H2O;
+2H2O; +2NaOH
+2NaOH| H2O |
| △ |
 +H2O+NaCl;
+H2O+NaCl; +2CH3COOH
+2CH3COOH| 浓硫酸 |
| △ |
 +2H2O;
+2H2O; +2NaOH
+2NaOH| H2O |
| △ |
 +H2O+NaCl;
+H2O+NaCl; ,与之互为同分异构体,属于酯类且含有苯环的化合物分一个取代基有
,与之互为同分异构体,属于酯类且含有苯环的化合物分一个取代基有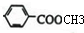 、
、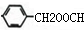 、
、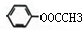 共3种,2个取代基的有-CH3和-OOCH分邻间对3种,所以共6种,故答案为:6;
共3种,2个取代基的有-CH3和-OOCH分邻间对3种,所以共6种,故答案为:6;


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A=B |
| B、A=10-4 B |
| C、B=10-4 A |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组设计的实验装置图如图.请回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+):①=②>③=④ |
| B、将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充电时转移1mol电子则生成0.5mol H2SO4 |
| B、放电时正极的电极反应为:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
| C、充电时,电池上标注“+”的电极应与外接电源的正极相连 |
| D、放电时,Pb失电子发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com