
| A、由水电离的c(H+):①=②>③=④ |
| B、将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
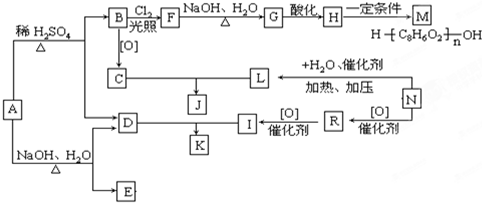

| NaOH、H2O |
| △ |
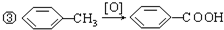
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3溶液与BaCl2溶液混合有白色沉淀生成,加稀HNO3沉淀不消失 |
| B、将SO2气体通入足 量Ba(OH)2溶液中有白色沉淀生成,加足 量HCl后沉淀消失 |
| C、将SO2气体通入BaCl2溶液中有白色沉淀生成,加稀HCl后沉淀消失 |
| D、将SO2气体通入氯水中无沉淀生成,加入BaCl2溶液有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 C2H4 |
| B、CH4 C3H6 |
| C、C2H4 C3H4 |
| D、C2H2 C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ.写出该反应的热化学方程式:
(1)已知298K时,1mol C2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1 558.3kJ.写出该反应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCOO-)<c(Na+) |
| B、c(HCOO-)>c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、c(Na+)=c(HCOO-)+c(HCOOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个金属原子失去电子的多少 |
| B、1摩金属失去电子的多少 |
| C、原子失去电子能力的大小 |
| D、1摩金属与水反应放出H2的多少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com