
| A. | CH4 | B. | P4 | C. | H2O2 | D. | C2H2 |
分析 非极性共价键为同种非金属元素的原子间形成共价键;极性共价键是由不同种非金属元素的原子间易形成的共价键;由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,据此进行判断.
解答 解:A.甲烷分子中只有C-H极性键,不存在非极性键,故A错误;
B.白磷分子中的共价键为非极性键,不存在极性键,故B错误;
C.H2O2分子中含有氧氢极性共价键和氧氧非极性共价键,但是双氧水结构不对称,属于极性分子,故C错误;
D.乙炔分子中含有碳氢极性键和碳碳非极性键,由于乙炔分子结构对称,乙炔分子为非极性分子,故D正确;
故选D.
点评 本题考查化学键的极性、分子极性,题目难度不大,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,试题培养了学生灵活应用所学知识解决实际问题的能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用滤纸过滤除去溶液中的胶体粒子 | |
| B. | 溶液中溶质的粒子运动有规律,胶体粒子运动无规律 | |
| C. | 一束光线通过溶液没有特殊现象,一束光线通过胶体时出现光亮的“通路” | |
| D. | 通直流电后,溶液中溶质的粒子分别向两极运动,而胶体中分散质的粒子向某一极运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开展生态旅游 | B. | 发展畜牧业 | C. | 增加木材产量 | D. | 改善生态环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
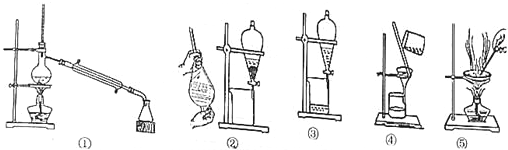
| 操作名称 | 适用对象或利用的物理性质 | 装置仪器 | 典型示例 |
| 过滤 | 除去江水中的泥沙 | ||
| 从食盐中获取NaCl晶体 | |||
| 将CCl4与水分离开 | |||
| ② | |||
| 蒸馏 | 从海水中获取淡水;工业上提纯酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
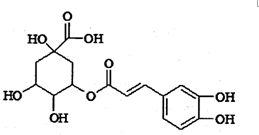 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )| A. | 绿原酸分子中含有3种官能团 | |
| B. | 1 mol绿原酸最多能与7molNaOH发生反应 | |
| C. | 绿原酸能发生取代反应、加成反应和消去反应 | |
| D. | 绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com