
【题目】日常生活中常用到许多化学知识,下列说法不正确的是( )
A. 热的纯碱(Na2CO3)水溶液(显碱性)可清洗油污
B. 将含有甲醇的工业酒精兑制成饮用白酒
C. 不能用苏丹红(色素)作食品的着色剂
D. 蚕丝和羊毛都属于动物纤维,又称蛋白纤维
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:①3SiO2+6C+2N2![]() Si3N4+6CO;也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3
Si3N4+6CO;也可由SiCl4的蒸汽和NH3反应制取:②3SiCl4+4NH3![]() Si3N4+12HCl。则下列叙述正确的是
Si3N4+12HCl。则下列叙述正确的是
A. 反应②属于离子反应
B. 若制取等量的Si3N4,则反应①②转移电子数目必然相等
C. 反应①的氧化剂是N2
D. 反应①中氧化产物与还原产物物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
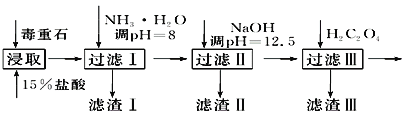
(1)毒重石用盐酸浸取前需充分研磨,目的是_______________________________________;实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)查阅有关资料获得沉淀各种杂质离子的pH见下表:
沉淀杂质离子 | Ca2+ | Mg2+ | Fe3+ |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去______(填离子符号);滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ.准确移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入几滴酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ.准确移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(选填“上方”或“下方”)。BaCl2溶液的浓度为________________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则所测得Ba2+浓度测量值将________(选填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素构成的双原子单质分子有三种,其式量分别为158、160、162.在天然单质中,此三种单质的物质的量之比为1:1:1,由此推断以下结论中,正确的是( )
A.此元素有三种同位素
B.其中一种同位素质量数为80
C.其中质量数为79的同位素原子占原子总数的 ![]()
D.此元素的单质的平均式量为160
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1mol H2(g)和1mol I2(g),压强为P(Pa),并在一定温度下使其反应:H2(g)+I2(g)![]() 2HI(g) △H<0.
2HI(g) △H<0.
(1)保持容器的容积不变,向其中加入1mol H2,反应速率_____(填“加快”“减慢”“无影响”), 理由是_______________________________________________________________.
(2)保持容器的容积不变,向其中加入1molN2(不参与反应),反应速率______.(填“加快”“减慢”“无影响”) 理由是________________________________________________.
(3)保持容器内气体的压强不变,向其中加入1mol N2(不参与反应),反应速率____.(填“加快”“减慢”“无影响”) 理由是_____________________________________________.
(4)保持容器内气体的压强不变,向其中加入1mol H2和1mol I2(g),反应速率______.(填“加快”“减慢”“无影响”) 理由是____________________________________________.
(5)提高起始的反应温度,反应速率______.(填“加快”“减慢”“无影响”) 理由是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,下图是N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,

请写出N2和H2反应的热化学方程式:______________________________________________;
(2)若已知下列数据:
化学键 | H-H | N≡N |
键能/kJ mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能____________kJ mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后的变化是:E1_______,△H________ (填“增大”、“减小、” “不变”)。
(4)用NH3催化还原NO2还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=akJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=bkJ·mol-1
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3=_________kJ/mol (用含a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%的酒精溶液(P<1)
B. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L-1
C. 实验中需用2.0mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分数分别为950mL、201.4g
D. 实验室配制500mL 0.2mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO47H2O),放入小烧杯中加水溶解,转移到500mL容量瓶、稀释、定量、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼金厂的废水中含有CN﹣有剧毒,其性质与卤素离子相似,还原性介于I﹣与Br﹣之间,HCN为弱酸.下列说法不正确的是
A.CN﹣可以和稀硫酸反应生成HCN
B.CN﹣可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F﹣还原
D.常温下NaCN溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是白色砂状或淡黄色粉末固体,己知连二业硫酸钠在碱性条件下较稳定,易被空气氧化,不溶于甲醇,遇水迅速分解,某同学设计利用如下图所示的实验装置制备一定量的连二亚硫酸钠,装置C中的试剂为甲酸钠(HCOONa)、NaOH 的甲醇溶液,回答下列问题:
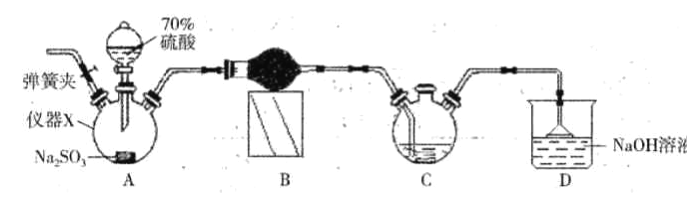
(1)仪器X的名称是_____。装置B中的球形干燥管中盛装的试剂是_______。
(2)装置D的作用是___________。实验时需要将C中温度控制在70-75℃,最好的控制方法是__________。
(3)实验开始时先打开装置A中的弹簧夹通入一段时间N2的目的是______。实验过程中装置C 中除有气体产生外,还能观察到的实验现象为____________。
(4)有同学通过仔细思考后认为,还应在C、D 之间添加一个装置,才能确保C中生成能稳定存在的连二亚硫酸钠,则该装置应具有的功能是______。为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸钠进行洗涤,洗涤的方法是_________。
(5)若实验中所用Na2SO3的质量为12.6g (硫酸是过量的),最终得到m g干燥的连二亚硫酸钠,则连二亚硫酸钠的产率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com