
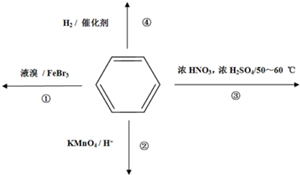
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰为淡蓝色 | |
| C. | 反应③为取代反应,有机产物是一种烃的衍生物 | |
| D. | 反应④中1 mol苯最多与6 mol H2发生加成反应 |
分析 A.苯与液溴发生取代反应,生成溴苯,溴苯的密度比水大;
B.苯能与在空气中能燃烧,燃烧时火焰明亮并带有浓烟;
C.苯能与硝酸发生硝化反应生成硝基苯,硝基苯中除了含有C、H,还含有N和O;
D.苯和氢气在一定条件下能发生加成反应,1mol苯和氢气发生加成反应最多需要3mol氢气.
解答 解:A.苯与液溴发生取代反应,生成溴苯,溴苯的密度比水大,所以与水混合沉在下层,故A错误;
B.苯能与在空气中能燃烧,发生氧化反应,苯中含碳量较高,燃烧时火焰明亮并带有浓烟,故B错误;
C.苯与浓硫酸及浓硝酸在50-60℃时发生取代反应,苯环上的一个氢原子被硝基取代,反应方程式为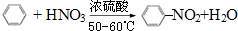 ,硝基苯中除了含有C、H,还含有N和O,属于烃的衍生物,故C正确;
,硝基苯中除了含有C、H,还含有N和O,属于烃的衍生物,故C正确;
D.苯中不含碳碳双键和碳碳单键,是一种介于单键和双键之间的特殊键,苯和氢气在一定条件下能发生加成反应,1mol苯和氢气发生加成反应最多需要3mol氢气,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确苯的结构和性质、基本概念是解本题关键,注意苯中存在的化学键,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
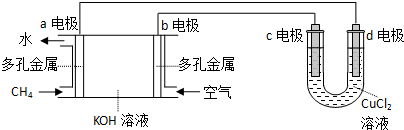
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
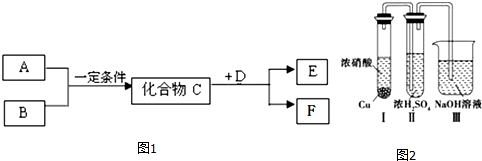
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | 紫色石蕊试液(Na2CO3溶液、NaHCO3溶液) |
| 鉴别棉花和蚕丝 | 灼烧 |
| 除去乙烷中混有的乙烯 | 溴水(溴的CCl4溶液) |
| 除去苯中溶解的溴单质 | NaOH溶液 |
| 海水淡化 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:③>②>① | |
| B. | 浓度均为0.1mol/L的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③ | |
| C. | 在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解 | |
| D. | 在CH3COONa溶液中加入冰醋酸,能控制CH3COO-水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com