
分析 (1)乙醇能被高锰酸钾氧化,反应方程式为5CH3CH2OH+4KMnO4+6H2SO4=4MnSO4+5CH3COOH+11H2O+2K2SO4;
(2)通过平衡移动分析解答;
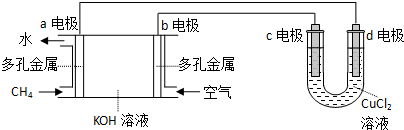
(3)①a极通的是燃料甲烷,所以是负极;
②d电极与电源的负极相连是阴极,铜离子放电,生成单质铜,电极反应式为Cu2++2e-=Cu;
③假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,整个电路转移的物质的量为:$\frac{3.2g}{64g/mol}$×2=0.05mol×2=0.1mol,消耗氧气的物质的量为:$\frac{0.05mol}{4}$×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L,所以空气的体积为$\frac{0.56L}{20%}$=2.8L.
解答 解:(1)乙醇能被高锰酸钾氧化,反应方程式为5CH3CH2OH+4KMnO4+6H2SO4=4MnSO4+5CH3COOH+11H2O+2K2SO4,故答案为:5CH3CH2OH+4KMnO4+6H2SO4=4MnSO4+5CH3COOH+11H2O+2K2SO4.3分)
(2)溴水中HBrO将乙醛氧化,Br2和水的反应平衡正向移动,导致溴水褪色,故答案为:溴水中HBrO将乙醛氧化,Br2和水的反应平衡正向移动,溴水褪色;
(3)①a极通的是燃料甲烷,所以是负极,故答案为:负极;
②d电极与电源的负极相连是阴极,铜离子放电,生成单质铜,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
③假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,整个电路转移的物质的量为:$\frac{3.2g}{64g/mol}$×2=0.05mol×2=0.1mol,消耗氧气的物质的量为:$\frac{0.05mol}{4}$×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L,所以空气的体积为$\frac{0.56L}{20%}$=2.8L,故答案为:2.8.
点评 本题综合考查了原电池原理,为高频考点,明确原电池正负极的判断方法是解本题关键,原电池原理是高中化学的重点也是难点,要注意掌握原电池原理,把握本质,正确书写电极反应方程式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Ca>S | B. | 金属性强弱:Na<Mg | ||
| C. | 酸性强弱:HBrO4>HClO4 | D. | 碱性强弱:NaOH>KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
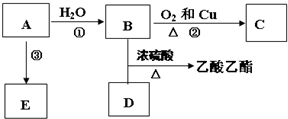
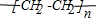 ,E不能(填“能”或“不能”)使酸性KMnO4溶液褪色.
,E不能(填“能”或“不能”)使酸性KMnO4溶液褪色. 2CH3CHO+2H2O,反应类型氧化反应;B+DCH3COOH+C2H5OH
2CH3CHO+2H2O,反应类型氧化反应;B+DCH3COOH+C2H5OH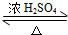 CH3COOC2H5+H2O,反应类型酯化(或取代)反应.
CH3COOC2H5+H2O,反应类型酯化(或取代)反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH和CH2═CH-CH═CH2 | B. | CH3-CH═CH2和CH3-CH2-CH═CH2 | ||
| C. | CH3-CH3和CH3-CH═CH2 | D. | 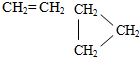 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物属于饱和链烃 | |
| B. | 该有机物可由两种单炔烃分别与氢气加成得到 | |
| C. | 该烃与2,3-二甲基丁烷互为同系物 | |
| D. | 该烃的一氯取代产物共有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
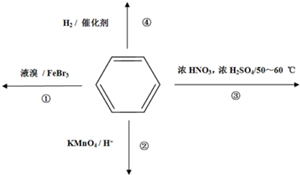
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰为淡蓝色 | |
| C. | 反应③为取代反应,有机产物是一种烃的衍生物 | |
| D. | 反应④中1 mol苯最多与6 mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com