
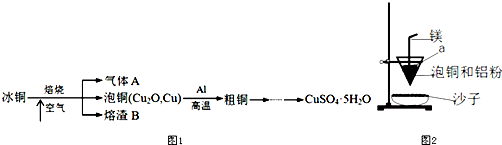
分析 由流程可知,冰铜焙烧时生成气体A为二氧化硫,滤渣B含氧化铁,泡铜中含Cu、Cu2O,Cu2O与Al发生铝热反应生成氧化铝和Cu,
(1)气体A为SO2,可用碱液吸收;
(2)①Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应;
②③镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧;
(3)发生2H2S+O2=2S+2H2O(a),2H2S+3O2=2SO2+2H2O(b),结合反应的方程式以及体积的变化利用差量法计算;
(4)①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ/mol
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ/mol
由盖斯定律可知①+②得到SiCl4(s)+2H2(g)=Si(s)+4HCl(g),以此来解答.
解答 解:(1)气体A为SO2,可用碱液吸收,则应用NaOH或氨水,故答案为:cd;
(2)①3Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$6Cu+Al2O3,
故答案为:3Cu2O+2Al$\frac{\underline{\;高温\;}}{\;}$6Cu+Al2O3;
②镁带起到引燃作用,燃烧放出大量的热,创造高温环境,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧,
故答案为:燃烧放出大量的热,创造高温环境(或引燃剂);
③白色固体为氯酸钾(或KClO3),故答案为:氯酸钾(或KClO3);
(3)2H2S+O2=2S+2H2O(a) 2H2S+3O2=2SO2+2H2O(b),
由反应知,当H2S:O2>2:1时,按(a)进行,气体体积可能减少30%,
当2:1>H2S:O2>2:3时既有反应(a)又有反应(b),气体体积可能减少30%,
设原混合气体中H2S、O2分别为x、yL,
Ⅰ2H2S+O2=2S+2H2O 气体体积减少,
2y y 2y y
∴$\frac{y}{x+y}$=0.3 $\frac{x}{y}$=$\frac{7}{3}$
∴$\frac{7}{3+7}$=0.7,
ⅡxH2S+yO2=(y-$\frac{x}{2}$)SO2+(1.5x-y)S+xH2O 气体体积减少
x y (y-$\frac{x}{2}$) $\frac{x}{2}$
∴$\frac{0.5x}{x+y}$=0.3 $\frac{x}{y}$=$\frac{3}{2}$
∴$\frac{3}{2+3}$=0.6
故答案为:0.6或0.7;
(4)①SiCl4(s)+H2(g)═SiHCl3(s)+HCl(g)△H1=47kJ/mol
②SiHCl3(s)+H2(g)═Si(s)+3HCl(g)△H2=189kJ/mol
由盖斯定律可知①+②得到SiCl4(s)+2H2(g)=Si(s)+4HCl(g),△H═+236kJ/mol,
则由SiCl4制备硅的热化学方程式为SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol.
点评 本题综合考查制备实验的涉及以及物质的分离提纯知识,侧重于综合考查学生的实验能力和数据分析能力,注意把握实验原理和实验方法,本题难点为混合物的计算,注意把握反应的化学方程式,利用差量法计算,题目难度中等.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol | |
| B. | 0.1 mol水蒸气在标准状况下体积为2.24 L | |
| C. | 在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 | |
| D. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、HCO3- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Fe3+、Mg2+、SO42-、NO3- | D. | Cu2+、K+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)=c(SO42-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | 2c(NH4+)=c(SO42-) | D. | c(OH-)+c(SO42-)=c(H+)+c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
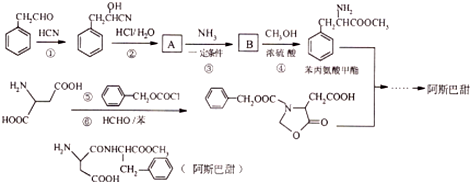
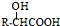 $→_{一定条件}^{NH_{3}}$
$→_{一定条件}^{NH_{3}}$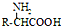
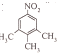 、
、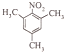 ;
;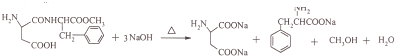 ;
;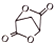 的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH:
的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH: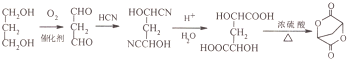 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
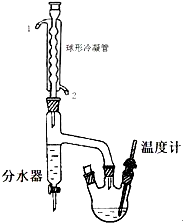 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 乙醇溶液、臭氧、双氧水、高锰酸钾溶液均可用于消毒杀菌,且原理不同 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 纯碱是焙制糕点所用的发酵粉的主要成分之一,也可用纯碱除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
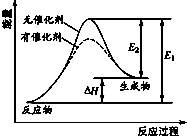
| A. | 该反应为放热反应 | |
| B. | 催化剂能降低该反应的焓变 | |
| C. | 催化剂能降低E2的值 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com