
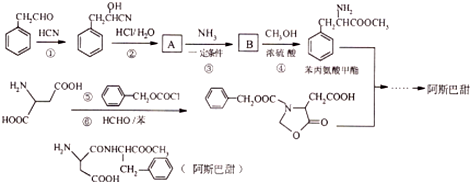
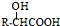 $→_{一定条件}^{NH_{3}}$
$→_{一定条件}^{NH_{3}}$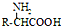
 、
、 ;
; ;
; 的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH:
的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH: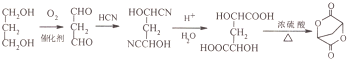 .
. 分析 (1)根据题中已知的条件,可知反应②是将反应物中的-CN变成-COOH,所以A的结构简式为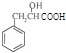 ;
;
(2)反应①是醛基与HCN加成,生成羟基腈,反应⑤氨基中的一个H被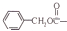 取代;
取代;
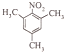
(3) 与氨气反应生成的B为
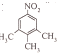
与氨气反应生成的B为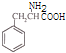 ,有三种化学环境不同的氢原子说明分子很对称三个碳分布在苯环的间位,中性物质说明氮原子形成了硝基,据此可以写出结构简式为:
,有三种化学环境不同的氢原子说明分子很对称三个碳分布在苯环的间位,中性物质说明氮原子形成了硝基,据此可以写出结构简式为: 和
和
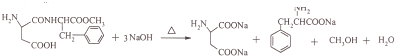
(4)阿斯巴甜与足量NaOH水溶液充分反应,其中酯基和肽键能水解,羧基被中和,所有方程式: ;
;
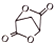
(5)根据产物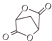 和原料(HOCH2-CH2-CH2OH)比较要知,碳原子数增加了两个,且产物是一个很对称的结构,将产物水解后得到
和原料(HOCH2-CH2-CH2OH)比较要知,碳原子数增加了两个,且产物是一个很对称的结构,将产物水解后得到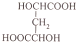 ,再对比原料可知,在原料上再引入两个碳原子,可以参照题目流程中的第①②步骤,可以达到目的,据此答题.
,再对比原料可知,在原料上再引入两个碳原子,可以参照题目流程中的第①②步骤,可以达到目的,据此答题.
解答 解:(1)根据题中已知的条件,可知反应②是将反应物中的-CN变成-COOH,所以A的结构简式为 ,故答案为:羟基、羧基;
,故答案为:羟基、羧基;
(2)反应①是醛基与HCN加成,生成羟基腈,反应⑤氨基中的一个H被 取代,故答案为:加成;取代;
取代,故答案为:加成;取代;
(3) 与氨气反应生成的B为
与氨气反应生成的B为 ,有三种化学环境不同的氢原子说明分子很对称三个碳分布在苯环的间位,中性物质说明氮原子形成了硝基,据此可以写出结构简式为:
,有三种化学环境不同的氢原子说明分子很对称三个碳分布在苯环的间位,中性物质说明氮原子形成了硝基,据此可以写出结构简式为: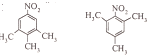 ,
,
故答案为: 、
、 ;
;
(4)阿斯巴甜与足量NaOH水溶液充分反应,其中酯基和肽键能水解,羧基被中和,所有方程式: ,
,
故答案为: ;
;
(5)根据产物 和原料(HOCH2-CH2-CH2OH)比较要知,碳原子数增加了两个,且产物是一个很对称的结构,将产物水解后得到
和原料(HOCH2-CH2-CH2OH)比较要知,碳原子数增加了两个,且产物是一个很对称的结构,将产物水解后得到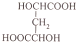 ,再对比原料可知,在原料上再引入两个碳原子,可以参照题目流程中的第①②步骤,可以达到目的,写出的流程为:
,再对比原料可知,在原料上再引入两个碳原子,可以参照题目流程中的第①②步骤,可以达到目的,写出的流程为: ,
,
故答案为: .
.
点评 本题主要考查了有机推断与合成,涉及的知识点官能团的识别、同分异构体的书写、化学方程式的书写、有机合成路线的选择等知识点,中等难度.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为NA | |
| C. | 1mol碳正离子CH5+所含的电子数为10NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=3:8时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.25g NaCl | |
| B. | 用酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用量筒量取10.51 mL盐酸 | |
| D. | 用容量瓶配制216mL 0.1mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应 CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热 CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳 2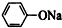 +CO2+H2O→2 +CO2+H2O→2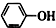 +Na2CO3 +Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ②⑤ | C. | ③⑤⑥ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中肼作还原剂 | |
| B. | 液态肼的燃烧热△H为-641.6kJ•mol-1 | |
| C. | 该动力源的突出优点之一是生成物对环境污染小 | |
| D. | 肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com