
【题目】甲苯是重要的有机化工原料,以甲苯为原料,制备香料、药物中间体(M)和高分子化合物(N)的一种合成路线如下:

已知:R1CHO+R2CH2CHO![]()
![]()
![]()
![]() (R1、R2表示氢原子或烃基)。
(R1、R2表示氢原子或烃基)。
请回答下列问题:
(1)B中官能团的名称为______________________,E的化学名称为____________________。
(2)H→N的反应类型为_______________________________。
(3)G分子中最多有________个碳原子共平面。顺式-N的结构简式为_____________________。
(4)C+D→M的化学方程式为_________________________________________。
(5)同时满足下列条件的H 的同分异构体有___________种(不考虑立体异构)。
①苯环上连接2个取代基
②能发生银镜反应,且1mol最多生成4molAg
(6)参照上述合成路线和信息,写出以甲醇和乙醛为原料(无机试剂任选),设计制备![]() 的合成路线:______________________________________________。
的合成路线:______________________________________________。
【答案】羧基 对甲基苯甲醛(或4-甲基苯甲醛) 加聚反应 10 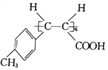
 12
12 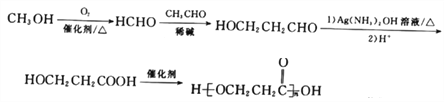
【解析】
(1)甲苯在酸性高锰酸钾中被氧化为苯甲酸,所以B上的官能团为羧基。E的化学名称为对甲基苯甲醛。
(2)由题干中的已知信息,可以推出从E到H的反应流程如下: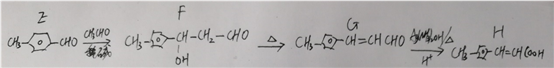 可以看出从H到N是一个加聚反应。
可以看出从H到N是一个加聚反应。
(3)从G的结构可以看出来,苯环上6个C和苯环上的甲基上的C共面,双键两端和醛基上的C共面,所以最多有10个C共面,顺式-N的结构简式为 。
。
(4)C+D→M是一个取代反应:
(5)根据题意可知,有两个醛基,取代基共有四种组合分别是![]() -CHO和-CH2CH2CHO,
-CHO和-CH2CH2CHO,![]() -CHO和-CH(CHO)CH3,
-CHO和-CH(CHO)CH3,![]() -CH2CHO和-CH2CHO,
-CH2CHO和-CH2CHO,![]() -CHO和
-CHO和![]() ,每种取代基的组合又分别有邻、间、对三排列方式,所以符合条件的同分异构体数目为12。
,每种取代基的组合又分别有邻、间、对三排列方式,所以符合条件的同分异构体数目为12。
(6)


科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一恒容密闭容器中,发生反应:N2+3H2![]() 2NH3,下列能说明反应已达到平衡状态的是( )
2NH3,下列能说明反应已达到平衡状态的是( )
①体系的压强不变 ②体系的密度不变 ③各组分的物质的量浓度不变 ④各组分的质量分数不变 ⑤反应速率υ(N2):υ(H2)=1:3 ⑥混合气体的总物质的量不变⑦混合气体的平均相对分子质量不变 ⑧一个N≡N键断裂的同时,有2个N—H键的断裂 ⑨c(N2):c(H2):c(NH3)=1:3:2
A. ②③⑥⑦⑨B. ②③⑤⑧⑨
C. ①③④⑥⑦D. ①④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图A、B、C三个装置,回答下列问题:
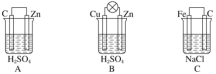
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,可观察到锌片上有气泡,再平行插入一碳棒,可观察到碳棒上没有气泡产生。用导线把锌片和碳棒连接起来组成一个原电池(图A),正极的反应式为_____。
(2)如果烧杯中最初装入的是500 mL 2 mol/L硫酸溶液,构成铜锌原电池(图B,假设产生的气体没有损失),当收集到11.2 L(标准状况下)H2时,溶液体积变化忽略不计,则烧杯内硫酸的物质的量浓度为______。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(图C),放置数天后,铁片生锈;负极的反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:____与盐酸反应最剧烈;_________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
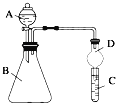
(3)仪器B的名称为_____,干燥管D的作用为_______。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C______的现象,即可证明,从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:N>C>Si,则在A中加硝酸、B中加碳酸钙,并在两装置间加一个除去挥发出来的HNO3的装置,C中加_____溶液观察到C中溶液白色沉淀,即可证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X为下列中的
A.Mg2+B.Fe2+C.Ba2+D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用的相对原子质量如S~32 Cl~35.5 Cu~64等,这些数值准确地说应该是
A. 某种核素的相对原子质量
B. 某种核素的近似相对原子质量
C. 某种元素的平均相对原子质量
D. 某种元素的平均相对原子质量的近似值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,22.4 L氨气分子所含原子总数为4NA
B. 在标准状况下,11.2 L二氯甲烷含氯原子总数为2NA
C. 32g氧气作氧化剂时转移电子数目一定为2NA
D. 1 mol环己烷(![]() )含非极性键数目为5NA
)含非极性键数目为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com