
| A、钠在空气中燃烧生成过氧化钠 |
| B、钠是银白色金属,硬度很大 |
| C、钠投入乙醇中,会浮在液面 |
| D、钠的保存要注意防水、防空气 |
| ||


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、充电时,阳极附近溶液由蓝色逐渐变为黄色 |
| B、放电过程中,正极附近溶液的酸性减弱 |
| C、充电时,反应每生成2mol H+时电子转移数为2mol |
| D、放电时,正极反应为VO2++2H++e-═VO2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | |||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C、将MgCl2溶液在蒸发皿中加热蒸干,得到无水MgCl2固体 |
| D、检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
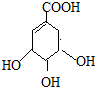 (提示:环丁烷
(提示:环丁烷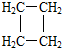 可简写成
可简写成 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
| B、pH=7的溶液 | ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、等体积0.1mol/L 硫酸与0.1mol/L的氢氧化钠溶液混合后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 |
| B、氢气的标准燃烧热为285.8 kJ?mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和反应的反应热△H=-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com