
A、溶液中c(H+)=
| ||
| B、pH=7的溶液 | ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、等体积0.1mol/L 硫酸与0.1mol/L的氢氧化钠溶液混合后的溶液 |
| KW |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在空气中燃烧生成过氧化钠 |
| B、钠是银白色金属,硬度很大 |
| C、钠投入乙醇中,会浮在液面 |
| D、钠的保存要注意防水、防空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O |
| CO2 |
| CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中NaHCO3和Na2O2物质的量一定相等 |
| B、容器中肯定有0.5molO2 |
| C、反应后,容器中的固体只有Na2CO3 |
| D、反应后,容器中一定没有H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
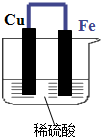 如图示的装置中
如图示的装置中查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com