
| KSP |
| C(Fe2+) |
| 6.25×10-18 |
| 1 |
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配置过程只需三种仪器即可完成 |
| B、容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配置 |
| C、所配得的NaClO消毒液在空气中光照久置后溶液中NaClO的物质的量浓度减少 |
| D、需要称量的NaClO固体的质量为148.75g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
| B、pH=7的溶液 | ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、等体积0.1mol/L 硫酸与0.1mol/L的氢氧化钠溶液混合后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、各物质的浓度之比为2:3:3 |
| B、混合物各物质的浓度相等 |
| C、A、B、C三种物质的浓度不随时间变化而变化 |
| D、ν正(A)、ν正(B)、ν正(C)之比为2:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B、手机上用的锂离子电池属于二次电池 |
| C、使用催化剂可改变工业合成NH3的反应限度 |
| D、生物质能本质上是太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
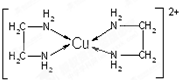
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com