
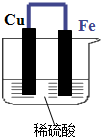
 如图示的装置中
如图示的装置中

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | |||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
| B、pH=7的溶液 | ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、等体积0.1mol/L 硫酸与0.1mol/L的氢氧化钠溶液混合后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B、手机上用的锂离子电池属于二次电池 |
| C、使用催化剂可改变工业合成NH3的反应限度 |
| D、生物质能本质上是太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氧气反应放出483.6kJ 热量 |
| B、氢气与氧气反应生成1mol 水蒸气时放出483.6kJ 热量 |
| C、2个H2分子燃烧生成水蒸气放出483.6kJ |
| D、2molH2与1molO2生成2mol水蒸气放出483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
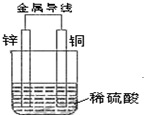 根据如图填空(涉及到电极填写具体物质的元素符号)
根据如图填空(涉及到电极填写具体物质的元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 |
| B、氢气的标准燃烧热为285.8 kJ?mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和反应的反应热△H=-57.3 kJ?mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积、等物质的量浓度的强酸中所含的H+数目一定相等 |
| B、标准状况下,6.02×1023个分子所占的体积约是22.4 L |
| C、同温同压下,相同体积的物质,它们的物质的量必定相等 |
| D、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com