
【题目】反应A(g)+B(g) ![]() C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )

A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H增大
C. △H < 0,反应达到平衡时,升高温度,A的转化率减少
D. △H > 0,反应达到平衡时,增大压强,A的转化率不变
科目:高中化学 来源: 题型:
【题目】室温,下列四种溶液中,由水电离生成的氢离子浓度之比①∶②∶③∶④是( )
①pH=0的盐酸②0.1 mol/L的氢碘酸③0.01 mol/L的NaOH溶液
④pH=11的氨水
A. 1∶10∶100∶1 000 B. 0∶1∶12∶11
C. 14∶13∶12∶11 D. 14∶13∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途与其体现的性质对应关系不合理的是( )
物质 | 用途 | 体现的性质 | |
A | SO2 | 生产硫酸 | 还原性 |
B | NH3 | 生产碳酸氢铵 | 还原性 |
C | SiO2 | 制取硅单质 | 氧化性 |
D | Fe2O3 | 冶炼金属铁 | 氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: .
(2)B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则该方程式为 . 已知煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,请写出其反应的化学方程式: .
(3)E能使湿润的红色石蕊试纸变蓝,工业上常用E为原料制取硝酸,写出E催化氧化的化学方程式; E和氯气接触会产生白烟,利用这一反应,化工厂的工人可用沾有浓氨水的玻璃棒检验输送氯气的管道是否漏气,该反应的化学方程式为
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质. 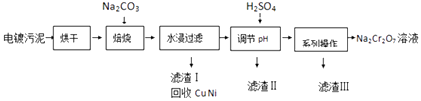
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
20℃ | 60℃ | 100℃ | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
(1)焙烧过程中生成Na2CrO4的化学方程式为;水浸后溶液中除Na2CrO4还存在的溶质有和;
(2)加入H2SO4调节pH的目的为;
(3)得到滤渣Ⅲ的“系列操作”的步骤为、过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42﹣有8/9转化为Cr2O72﹣ , 求转化后所得溶液中c(Cr2O72﹣)=molL﹣1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2 , 再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5 , 则发生反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.铁在热的浓硝酸中钝化B.CO2与Na2O2反应可产生O2
C.室温下浓硫酸可将石墨氧化为CO2D.SO2与过量漂白粉浊液反应生成CaSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.强酸性溶液:Mg2+、K+、SO ![]() 、NO
、NO ![]()
B.使酚酞变红色的溶液:Na+、Cu2+、HCO ![]() 、NO
、NO ![]()
C.0.1mol?L﹣1AgNO3溶液:H+、K+、SO ![]() 、I﹣
、I﹣
D.0.1mol?L﹣lNaAlO2溶液:H+、Na+、Cl﹣、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO28H2O)是一种在水产养殖中广泛使用的供氧剂.
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO28H2O.
Ca(OH)2+H2O2+6H2O═CaO28H2O
反应时通常加入过量的Ca(OH)2 , 其目的是
(2)箱池塘水中加入一定量的CaO28H2O后,池塘水中浓度增加的离子有(填序号).
A.Ca2+
B.H+
C.CO32﹣
D.OH﹣
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4 , 将MnO(OH)2与I﹣完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下: ![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO28H2O的池塘水样100.00mL,按上述方法测定水中溶解氧量,消耗0.01000molL﹣1Na2
S2O3标准溶液13.50mL.计算该水样中的溶解氧(用mgL﹣1表示),写出计算过程.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com