
【题目】室温,下列四种溶液中,由水电离生成的氢离子浓度之比①∶②∶③∶④是( )
①pH=0的盐酸②0.1 mol/L的氢碘酸③0.01 mol/L的NaOH溶液
④pH=11的氨水
A. 1∶10∶100∶1 000 B. 0∶1∶12∶11
C. 14∶13∶12∶11 D. 14∶13∶2∶3
【答案】A
【解析】在酸溶液中,OH-是水电离产生的,在碱溶液中,H+是水电离产生的,且水电离产生的氢离子浓度等于水电离产生的氢氧根离子浓度。①pH=0的盐酸,溶液中氢离子浓度为1mol/L,水电离产生的氢氧根离子浓度为: ![]() mol/L=1×10-14mol/L,则水电离产生的氢离子浓度为1×10-14mol/L;②0.1 mol/L的氢碘酸,氢碘酸是一元强酸,则溶液中的氢离子浓度为0.1mol/L,由水电离产生的氢氧根离子浓度为:
mol/L=1×10-14mol/L,则水电离产生的氢离子浓度为1×10-14mol/L;②0.1 mol/L的氢碘酸,氢碘酸是一元强酸,则溶液中的氢离子浓度为0.1mol/L,由水电离产生的氢氧根离子浓度为: ![]() mol/L=1×10-13mol/L,则水电离产生的氢离子浓度为1×10-13mol/L;③0.01 mol/L的NaOH溶液中,氢氧根离子浓度为0.01 mol/L,则由水电离产生的氢离子浓度为:
mol/L=1×10-13mol/L,则水电离产生的氢离子浓度为1×10-13mol/L;③0.01 mol/L的NaOH溶液中,氢氧根离子浓度为0.01 mol/L,则由水电离产生的氢离子浓度为: ![]() mol/L=1×10-12mol/L;④pH=11的氨水溶液中,氢离子浓度为1×10-11mol/L,因氢离子是由水电离产生的,则由水电离产生的氢离子浓度为1×10-11mol/L,因此四种溶液中,由水电离生成的氢离子浓度之比为:1×10-14: 1×10-13: 1×10-12: 1×10-11=1:10:100:1 000,故答案选A。
mol/L=1×10-12mol/L;④pH=11的氨水溶液中,氢离子浓度为1×10-11mol/L,因氢离子是由水电离产生的,则由水电离产生的氢离子浓度为1×10-11mol/L,因此四种溶液中,由水电离生成的氢离子浓度之比为:1×10-14: 1×10-13: 1×10-12: 1×10-11=1:10:100:1 000,故答案选A。


科目:高中化学 来源: 题型:
【题目】碘化钡(BaI22H2O)是一种白色粉末,常用于制取其他含碘化合物.一种制备流程如图1: 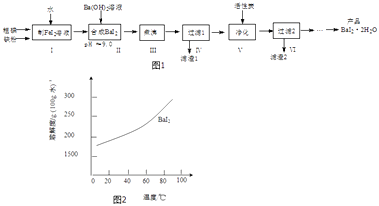
(1)步骤Ⅰ制FeI2溶液时,提高反应速率的可行措施有(填序号).
a.铁粉和碘粉用球磨机磨成细粉
b.增大n(铁粉):n(碘)的配料比
c.适当升高反应温度和搅拌速度
d.向反应器中加水至I2全部溶解
(2)步骤Ⅱ发生反应的化学方程式为;用pH试纸测定溶液pH的方法是
(3)步骤Ⅲ小心“煮沸”约20分钟,可使Fe(OH)2颗粒长大,其目的是;步骤V加入活性炭的目的是 .
(4)从过滤2所得滤液中获得BaI22H2O(溶解度曲线如图2所示)的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是
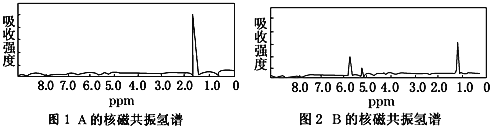
A. A是C3H6;B是C6H6 B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳架如图的烃(小黑球表示碳原子,黑球之间的连线表示共价键),下列说法正确的是( )
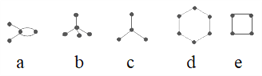
①a和e互为同分异构体 ②b是天然气的主要成分 ③d为平面型分子,属于芳香烃 ④b和c互为同系物 ⑤a、d、e的最简式相同
A. ①③⑤ B. ①②③ C. ②③④ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于碳原子成键特点的是( )
A.易失去最外层的电子形成离子
B.最外层电子易与其他原子的外层电子形成共用电子对
C.能够形成单键、双键和三键等多种成键形式
D.每个碳原子最多与其他原子形成4个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )

A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H增大
C. △H < 0,反应达到平衡时,升高温度,A的转化率减少
D. △H > 0,反应达到平衡时,增大压强,A的转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com