
����Ŀ���⻯����BaI22H2O����һ�ְ�ɫ��ĩ����������ȡ�������⻯���һ���Ʊ�������ͼ1�� 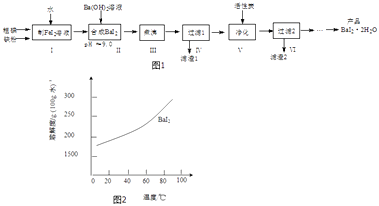
��1���������FeI2��Һʱ����߷�Ӧ���ʵĿ��д�ʩ��������ţ���
a�����ۺ͵������ĥ��ĥ��ϸ��
b������n�����ۣ���n���⣩�����ϱ�
c���ʵ����߷�Ӧ�¶Ⱥͽ����ٶ�
d����Ӧ���м�ˮ��I2ȫ���ܽ�
��2�����������Ӧ�Ļ�ѧ����ʽΪ����pH��ֽ�ⶨ��ҺpH�ķ�����
��3�������С�ġ���С�Լ20���ӣ���ʹFe��OH��2����������Ŀ����������V�������̿��Ŀ���� ��
��4���ӹ���2������Һ�л��BaI22H2O���ܽ��������ͼ2��ʾ���ķ����� ��
���𰸡�
��1��a c
��2��FeI2+Ba��OH��2=Fe��OH��2��+BaI2����һС��pH��ֽ���ڱ������ϣ��ò�����պȡ������Һ������ֽ���в�����ֽ��ɫ�����������ɫ���Ƚ�ȷ����Һ��pH
��3�����ڣ�����������˷��룻����Fe��OH��2���л����ʵ�
��4������Ũ������ȴ�ᾧ
���������⣺��1��a�����ۺ͵������ĥ��ĥ��ϸ�ۣ��������ĽӴ����������߷�Ӧ���ʣ�����ȷ��
b������n�����ۣ���n���⣩�����ϱȣ�����ĽӴ�������䣬��Ӧ���ʲ��䣬�ʴ���
c���ʵ����߷�Ӧ�¶Ⱥͽ����ٶȣ�����߷�Ӧ���ʣ�����ȷ��
d����Ӧ���м�ˮ��I2ȫ���ܽ⣬��Ũ�ȼ�С����Ӧ���ʼ�С���ʴ���
��ѡ��a c����2�������FeI2��Һ����������������pHֵΪ9.0������Ӧ����BaI2��Һ��Fe��OH��2����������ʽΪ��FeI2+Ba��OH��2=Fe��OH��2��+BaI2����pH��ֽ�ⶨ��ҺpH�ķ����ǰ�һС��pH��ֽ���ڱ������ϣ��ò�����պȡ������Һ������ֽ���в�����ֽ��ɫ�����������ɫ���Ƚ�ȷ����Һ��pH��
���Դ��ǣ�FeI2+Ba��OH��2=Fe��OH��2��+BaI2����һС��pH��ֽ���ڱ������ϣ��ò�����պȡ������Һ������ֽ���в�����ֽ��ɫ�����������ɫ���Ƚ�ȷ����Һ��pH����3��ʹFe��OH��2����������ڣ�����������˷��룻��Ϊ����̿���������ԣ����Լ������̿��Ŀ��Ϊ����������Fe��OH��2���л����ʵȣ�
���Դ��ǣ����ڣ�����������˷��룻����Fe��OH��2���л����ʵȣ���4�����ܽ������ͼ��֪BaI2���ܽ�����¶ȱ仯�Ƚϴ����Դӹ���2������Һ�л��BaI22H2O�ķ���������Ũ������ȴ�ᾧ�����Դ��ǣ�����Ũ������ȴ�ᾧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���帯ʴ����ʱ������ϡ NaOH ��Һϴ������ˮϴ
B. ������ķ������Է���ˮ������ (�е� 20~200��)
C. ��ɫ��ѧ�ĺ����ǶԻ�����Ⱦ�������������
D. SO2 ����CaO��Ӧ����������ʯ����ҵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.����pH��ֽ��������ˮ��pH
B.����ƿʹ��ǰҪ��©
C.�������ֱ���þƾ��Ƽ���
D.����ʱ���ӷ�ʯ������ȴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ������й�˵����ȷ���ǣ� ��
A. Na2O2�Ǽ��������������DZˮͧ�еĹ���ҩƷ��
B. Fe2O3�׳����죬������������ɫ���ᡣ
C. �ռ��С�մ���������θ�����
D. ��������������������ԣ�����������ˮ��ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.6molX�����0.6mol Y��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��2X��g��+Y��g��=nZ��g��+2W��g����2minĩ������0.2mol W������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.1molL��1min��1 �� ���㣺
��1��ǰ2min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ���ʣ�
��2��2minĩʱY��Ũ�ȣ�
��3����ѧ��Ӧ����ʽ��n��ֵ�Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĵ���ʽ��д��ȷ���ǣ� ��
A.Na2O Na ![]() [
[ ![]()
![]()
![]() ]2��
]2��
B.H2S H+[ ![]()
![]()
![]() ]2��H+
]2��H+
C.H2O2 H ![]()
![]()
![]()
![]()
![]() H
H
D.N2 N:::N
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ������������������(�����ڵ�����)��ѡ�õ��Լ�����ȷ����(����)
A.����(������)��NaOH��Һ
B.����(��Ȳ)����ˮ
C.��(������)��NaOH��Һ
D.��Ȳ(����)����������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.������ȼ����Ϊ��H=��285.5kJ?mol��1 �� ����ˮ���Ȼ�ѧ����ʽΪ2H2O��l�� ![]() 2H2��g��+O2��g����H=+285.5k?Jmol��1
2H2��g��+O2��g����H=+285.5k?Jmol��1
B.��ӦSO2��g��+2H2S��g���T3S��s��+2H2O��l���ڳ��������Է����У���÷�Ӧ�ġ�H��0
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g���T2NH3��g����H=��38.6k?Jmol��1
D.��C��ʯī��s��=C�����ʯ��s����H=+1.90 k?Jmol��1��֪�����ʯ��ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����£�����������Һ�У���ˮ�������ɵ�������Ũ��֮�Ȣ١âڡâۡâ���(����)
��pH=0�������0.1 mol/L��������0.01 mol/L��NaOH��Һ
��pH=11�İ�ˮ
A. 1��10��100��1 000 B. 0��1��12��11
C. 14��13��12��11 D. 14��13��2��3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com