
【题目】下列不属于碳原子成键特点的是( )
A.易失去最外层的电子形成离子
B.最外层电子易与其他原子的外层电子形成共用电子对
C.能够形成单键、双键和三键等多种成键形式
D.每个碳原子最多与其他原子形成4个共价键
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.1molL﹣1min﹣1 , 计算:
(1)前2min内用X的浓度变化表示的平均反应速率.
(2)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( ) 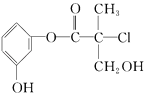
A.该有机物能与溴水发生加成反应
B.该有机物与浓硫酸混合加热可发生消去反应
C.1mol该有机物与足量NaOH溶液反应最多消耗3mol NaOH
D.该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO﹣+Cl﹣+H2O
B.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42﹣+2Ba2++5OH﹣=AlO2﹣+2BaSO4↓+NH3H2O+2H2O
C.制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3(胶体)+3H+
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温,下列四种溶液中,由水电离生成的氢离子浓度之比①∶②∶③∶④是( )
①pH=0的盐酸②0.1 mol/L的氢碘酸③0.01 mol/L的NaOH溶液
④pH=11的氨水
A. 1∶10∶100∶1 000 B. 0∶1∶12∶11
C. 14∶13∶12∶11 D. 14∶13∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气. 
(1)根据图1回答:写出选用物质的名称:A , B , C
(2)烧瓶中反应的离子方程式为 ,
(3)根据图2回答:乙同学的实验原理是 ,
(4)B处的实验现象是;
(5)B处的反应的离子方程式: .
(6)有同学认为甲同学的实验设计有明显的不足,你认为不足之处为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第周期,第族;
(2)X可形成双原子分子,其分子的电子式是;Y和氢元素形成的10电子微粒中常见的+1价阳离子为(填化学式,下同);Z和氢元素形成的18电子微粒中常见的﹣1价阴离子为;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式: .
(2)B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则该方程式为 . 已知煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,请写出其反应的化学方程式: .
(3)E能使湿润的红色石蕊试纸变蓝,工业上常用E为原料制取硝酸,写出E催化氧化的化学方程式; E和氯气接触会产生白烟,利用这一反应,化工厂的工人可用沾有浓氨水的玻璃棒检验输送氯气的管道是否漏气,该反应的化学方程式为
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com