
【题目】(1) 常温下,向 1 L 0.1 mol·L-1 的的醋酸溶液中加入0.1 mol醋酸钠固体,则醋酸的电离平衡向______(填“正”或“逆”)反应方向移动;溶液中c (CH3COO-)·c(H+) / c (CH3COOH) 的值 __________(填“增大”、“减小”或“不变”)。
(2)常温时,测得0.1 mol·L-1 Na2A 溶液的pH=7。
① H2A在水溶液中的电离方程式为 ______________________ 。
② 该温度下,将0.01 mol·L-1 H2A溶液稀释20倍后,溶液的pH= _______ 。
③ 体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气 _________ 。(填序号)
A 、盐酸多 B、 H2A多 C、一样多 D、无法确定
【答案】 逆 不变 H2A = 2H+ + A2- 3 C
【解析】(1)在醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,加入醋酸钠,醋酸根离子浓度增大对醋酸的电离平衡逆移;Ka=![]() ,Ka不随浓度的变化而变化,只受温度影响,所以溶液中
,Ka不随浓度的变化而变化,只受温度影响,所以溶液中![]() 的值不变;故答案为:逆;不变;
的值不变;故答案为:逆;不变;
(2)在25℃时,Kw=1.0×10-14,该温度下纯水的pH=7,测得0.1molL-1 Na2A溶液的pH=7,说明Na2A是强酸强碱盐。
①H2A是强酸,在水溶液里完全电离,其电离方程式为H2A═2H++A2-,故答案为:H2A═2H++A2-;
②该温度下,将0.01molL-1 H2A溶液稀释到20倍后,溶液中氢离子浓度=0.01mol/L×2÷20=0.001mol/L,所以pH=3;故答案为:3;
③ 体积相等、pH=1的盐酸与H2A溶液中含有的氢离子的物质的量相等,分别与足量的Zn反应,产生的氢气 一样多,故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 向汽油中添加甲醇后,该混合燃料的热值不变
B. 光催化还原水制氢比电解水制氢更节能环保、更经济
C. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
D. 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
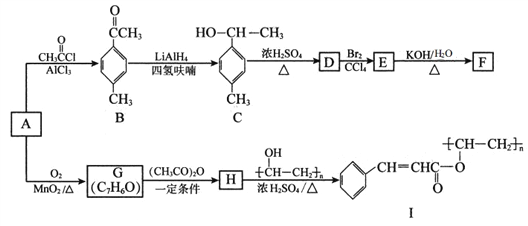
(1)A的分子式为____________,上述八个反应中,属于取代反应的共有_______个。
(2) D的名称为____________________,G分子中最多有_________个原子共面。
(3)由H生成I的化学方程式为_____________________________________________。
(4)符合下列条件的B的同分异构体有____________种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是_________(写出其中一种的结构简式)。
①属于芳香化合物;②能发生银镜反应。
(5)己知![]() ,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备 ![]() 的合成路线___________________________________。
的合成路线___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. SO2能使FeCl3、酸性KMnO4溶液迅速褪色
B. 可以用澄清石灰水来鉴别SO2与CO2
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 少量SO2通入浓的CaCl2溶液中可以生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
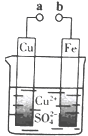
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制合成天然气是煤气化的一种重要方法,其工艺核心是合成过程中的甲烷化,涉及的主要反应:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH<0 ①
CH4(g)+H2O(g) ΔH<0 ①
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0 ②
CH4(g)+2H2O(g) ΔH<0 ②
现在300 ℃、容积为2 L的密闭容器中进行有关合成天然气的实验,相关数据记录如下:
CO/mol | CO2/mol | H2/mol | CH4/mol | H2O/mol | |
0 min | 4 | 3 | 40 | 0 | 0 |
30 min | 2 | 2 | a | 3 | |
70 min | 1 | b | c | d | 6 |
下列有关说法错误的是
A.a=30,b=1.5
B.c=25,d=4.5
C.前30 min内,反应①的平均反应速率v(CH4)=0.05 mol·L1·min1
D.后40 min内,反应②的平均反应速率v(H2)=0.025 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断不正确的是( )
A. 乙元素的族序数比甲元素的族序数大
B. 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C. 原子半径的大小:甲>乙
D. 含乙元素的化合物数目比含甲或丙元素的化合物数目多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、技术密切关。下列说法错误的是
A. “疫苗”等生物制剂需要冷冻保存 B. 明矾和二氧化氯处理水,原理相同
C. 用氢氟酸可进行玻璃雕刻 D. 小苏打和氢氧化铝均可用于中和胃酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com