
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。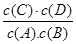 <
< 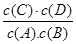 。因为升高温度,化学平衡常数减小,说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。所以该反应的正反应为放热反应。所以△H<0.(2)v(A)=0.003 mol·L-1·s-1,△c(A)= v(A)×△t=0.003 mol·L-1·s-1×6s=0.018mol/L则6s时c(A)=(0.20mol÷5 L)-0.018mol/L=0.022mol/L.C的物质的量0.018mol/L×5 L= 0.09mol。因为在830℃时化学平衡常数K=1.0.假设在反应的过程中A消耗的物质的量为x 则达到平衡时各物质的物质的量分别是A:(0.20-x)mol;B:(0.80-x)mol;C:xmol;D:xmol.由于各物质的方程式前边的系数都为1,所以达到平衡时的物质的量的比等于浓度的比。X2÷[(0.20-x)×(0.80-x)]=1.0.解得x=0.16.所以A的转化率为(0.16÷0.20)×100%=80%。如果这时向该密闭容器中再充入1 mol氩气,因为容器的容积不变。A的浓度不变,所以平衡不发生移动。故平衡时A的转化率也不变。(3)A.因为该反应是个反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,容器内气体的压强都不会发生改变。错误。B.由于在反应前后气体的体积不变,反应遵循质量守恒定律,质量也不变,因此任何时刻,无论反应是否达到平衡,气体的密度都不改变。错误。C.若反应未达到平衡,则 c(A)就会发生改变。现在c(A)不随时间改变,说明反应达到了平衡状态。正确。D.在方程式中,C和D都是生成物,系数相同,所以在任何时间段内单位时间里生成C和D的物质的量总是相等,因此不能以此为标准判断反应是否达到平衡状态。错误。故正确的选项为C。(4)在1200℃时A(g)+B(g)
。因为升高温度,化学平衡常数减小,说明升高温度,化学平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。所以该反应的正反应为放热反应。所以△H<0.(2)v(A)=0.003 mol·L-1·s-1,△c(A)= v(A)×△t=0.003 mol·L-1·s-1×6s=0.018mol/L则6s时c(A)=(0.20mol÷5 L)-0.018mol/L=0.022mol/L.C的物质的量0.018mol/L×5 L= 0.09mol。因为在830℃时化学平衡常数K=1.0.假设在反应的过程中A消耗的物质的量为x 则达到平衡时各物质的物质的量分别是A:(0.20-x)mol;B:(0.80-x)mol;C:xmol;D:xmol.由于各物质的方程式前边的系数都为1,所以达到平衡时的物质的量的比等于浓度的比。X2÷[(0.20-x)×(0.80-x)]=1.0.解得x=0.16.所以A的转化率为(0.16÷0.20)×100%=80%。如果这时向该密闭容器中再充入1 mol氩气,因为容器的容积不变。A的浓度不变,所以平衡不发生移动。故平衡时A的转化率也不变。(3)A.因为该反应是个反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,容器内气体的压强都不会发生改变。错误。B.由于在反应前后气体的体积不变,反应遵循质量守恒定律,质量也不变,因此任何时刻,无论反应是否达到平衡,气体的密度都不改变。错误。C.若反应未达到平衡,则 c(A)就会发生改变。现在c(A)不随时间改变,说明反应达到了平衡状态。正确。D.在方程式中,C和D都是生成物,系数相同,所以在任何时间段内单位时间里生成C和D的物质的量总是相等,因此不能以此为标准判断反应是否达到平衡状态。错误。故正确的选项为C。(4)在1200℃时A(g)+B(g) C(g)+D(g)的平衡常数
C(g)+D(g)的平衡常数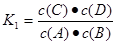 反应C(g)+D(g)
反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为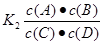 ;可见K1、K2互为倒数。因为此时K1=0.4,所以K2=1÷0.4=2 .5。
;可见K1、K2互为倒数。因为此时K1=0.4,所以K2=1÷0.4=2 .5。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:问答题
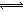 HOI(aq) △H2
HOI(aq) △H2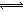 I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3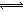 I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。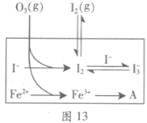
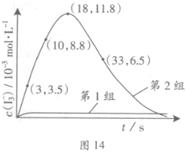
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+ I- | 5.2 | 11.0 |
| 第2组 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是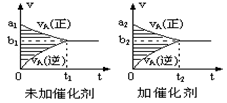
| A.②③⑤⑧ | B.①④⑥⑧ | C.②④⑤⑦ | D.①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OH(g)+ H2O(g)△H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g)△H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是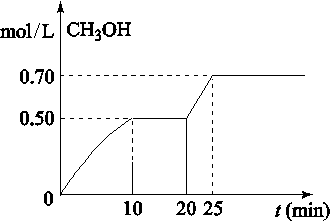
| A.从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min) |
| B.从20分钟到25分钟达到新的平衡,可能是增大压强 |
| C.其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小 |
| D.从开始到25分钟,CO2的转化率是70% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是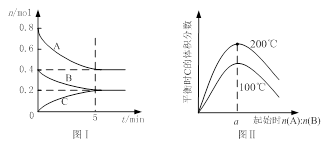
 zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )| A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )
cC(g);5min时,测得C为xmol。下列说法中一定正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com