


科目:高中化学 来源:不详 题型:填空题
 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
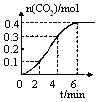
 Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。下列说法正确的是
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
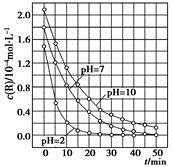
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 min | B.3 min | C.6 min | D.9 min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com