

分析 700℃对菱镁矿(主要成分为MgCO3,含少量的Fe2O3等杂质),MgCO3其中受热分解,发生反应MgCO3 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑,得到氧化镁和Fe2O3的混合物,向其中加入浓NH4Cl溶解氧化镁的氯化镁溶液,通入氨气得MgCl2•6NH3,再进行煅烧得到产品MgCl2,据此分析.
解答 解:700℃对菱镁矿(主要成分为MgCO3,含少量的Fe2O3等杂质),MgCO3其中受热分解,发生反应MgCO3 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑,得到氧化镁和Fe2O3的混合物,向其中加入浓NH4Cl溶解氧化镁的氯化溶液,通入氨气得MgCl2•6NH3,再进行煅烧得到产品MgCl2,
(1)700℃轻烧菱镁矿过程中,碳酸镁分解的化学方程式为:MgCO3 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑;
故答案为:MgCO3 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑;
(2)浸取过程中,浓NH4Cl溶液与氧化镁得到氯化镁,化学方程式为:MgO+H2O+2NH4Cl=MgCl2+2NH3•H2O;
故答案为:MgO+H2O+2NH4Cl=MgCl2+2NH3•H2O;
(3)MgCl2•6NH3进行煅烧得到产品MgCl2和氨气,氨气可用于氯化镁溶液得MgCl2•6NH3,可循环利用,
检验MgCl2•6NH3已完全分解的方法为对产品前后两次称量,若质量不再改变,说明已经分解完全,若质量变小,说明没有分解完全,需重复分解;
故答案为:NH3;前后两次称量质量不变(恒重法或检验氨气);
(4)MgCl2中镁离子与水能水解,MgCl2•6H2O中有水,煅烧MgCl2•6H2O镁离子发生水解得到氢氧化镁,煅烧最终得到氧化镁,故选用煅烧MgCl2•6NH3;
故答案为:MgCl2能与水发生水解,煅烧MgCl2•6H2O最终得到的是MgO;
(5)MgCl2在氨水中能与H2O2反应生成漂白剂MgO2,该反应的化学方程式为:MgCl2+H2O2+2 NH3•H2O=MgO2+2NH4Cl+2H2O;
故答案为:MgCl2+H2O2+2 NH3•H2O=MgO2+2NH4Cl+2H2O.
点评 本题考查物质准备工艺流程,涉及条件的控制与选择、对操作的分析评价等,注意掌握元素化合物性质,是对学生综合能力的考查,是高考常见题型.


科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子氧化性:A(n+1)+>Bn+离子还原性:C(n+1)->Dn- | |
| D. | C最高价氧化物的水化物的酸性比D的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si | B. | SiO2 | C. | Na2SiO3 | D. | SiCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
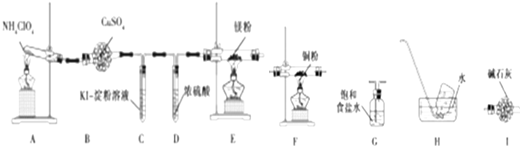
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
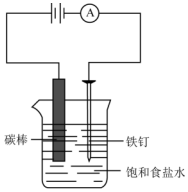 如图所示,回答下列问题:
如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过石油的裂解可以获得更多的汽油 | |
| B. | 蛋白质、纤维素、油脂、聚乙烯、淀粉都是高分子化合物 | |
| C. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| D. | 石油、煤、天然气、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁比生铁不易生锈 | |
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块能保护钢制外壳不受腐蚀,此方法叫做牺牲阳极的阴极保护法 | |
| D. | 电解精炼铜,阳极质量减少64g时,电子转移不一定是2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com