
【题目】化学上常用AG表示溶液中的酸碱度, 。
。![]() 时
时 用
用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 的
的![]() 溶液,AG与所加NaOH溶液的体积
溶液,AG与所加NaOH溶液的体积![]() 的关系如图所示,下列说法不正确的是
的关系如图所示,下列说法不正确的是![]()

A.随着NaOH溶液的加入, 增大
增大
B.![]() 时,
时,![]() 的电离常数
的电离常数![]()
C.b点溶液中存在![]()
D.a、b、c、d、e五点的溶液中,水的电离程度最大的点是d
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是

A.1个Ca2+周围距离最近且等距离的![]() 数目为4
数目为4
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,含碳微粒![]() 、
、![]() 、
、![]() 存在于
存在于![]() 草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数
草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数![]() 某微粒物质的量浓度与三种微粒物质的量浓度和比值
某微粒物质的量浓度与三种微粒物质的量浓度和比值![]() 与溶液pH的关系如图所示,下列有关说法错误的是
与溶液pH的关系如图所示,下列有关说法错误的是![]()
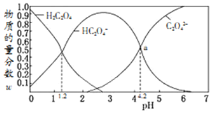
A.向![]() 的溶液中加NaOH溶液将pH增大至
的溶液中加NaOH溶液将pH增大至![]() 的过程中水的电离度一直增大
的过程中水的电离度一直增大
B.![]() 时,溶液中c
时,溶液中c![]()
![]()
![]()
C.![]() 若草酸的第二级电离平衡常数为
若草酸的第二级电离平衡常数为![]() ,则
,则![]()
D.将![]() 相同物质的量浓度
相同物质的量浓度![]() 和
和![]() 的两份溶液等体积混合,可配得图a点所示混合液
的两份溶液等体积混合,可配得图a点所示混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将![]() 气体通入aLbmo
气体通入aLbmo![]() 的NaOH溶液中,下列对所得溶液的描述不正确的是
的NaOH溶液中,下列对所得溶液的描述不正确的是![]()
A. 随着
随着 ![]() 气体的通入,溶液中由水电离出的
气体的通入,溶液中由水电离出的![]() 有如图变化关系
有如图变化关系
B.当![]() b时,所得溶液中存在:
b时,所得溶液中存在:![]()
C.当![]() b时,所得溶液中存在:
b时,所得溶液中存在:![]()
![]()
D.当![]()
![]() 时,所得溶液中一定存在:
时,所得溶液中一定存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选做[化学—选修3:物质结构与性质] (15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_____________(填化学式),原因是_________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为______________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____________(填化学式)。Na+的配位数为_____________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的W离子间距离为 nm(用含ρ、NA的计算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是
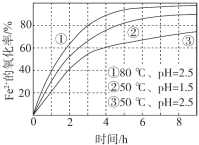
A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com