
【题目】下列说法正确的是( )
A.pH<7的溶液一定是酸性溶液
B.室温时,pH=5的溶液和pH=3的溶液相比,前者c(OH﹣)是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.HCl溶液中无OH﹣ , NaOH溶液中无H+ , NaCl溶液中既无OH﹣也无H+
【答案】B
【解析】解答:A.pH<7的溶液不一定是酸性溶液,如100℃时,纯水的pH=6,则6<pH<7的溶液呈碱性,所以A错误; B.pH=5的溶液中氢氧根离子浓度为: ![]() =10﹣9 , pH=3的溶液中氢氧根离子浓度为:
=10﹣9 , pH=3的溶液中氢氧根离子浓度为: ![]() =10﹣11 , 前者c(OH﹣)是后者的100倍,所以B正确;
=10﹣11 , 前者c(OH﹣)是后者的100倍,所以B正确;
C.室温下,1L水中10﹣7mol水发生电离,1L水的物质的量为: ![]() ,设每n个水中有一个水电离,则有:n:1=
,设每n个水中有一个水电离,则有:n:1= ![]() :10﹣7 ,
:10﹣7 ,
解得n=5.56×108 , 所以C错误;
D.由于水的电离平衡的存在,任何水溶液都存在氢离子和氢氧根离子,所以D错误;
所以选B.
分析:本题考查了水的电离平衡和PH的计算.注意判断溶液的酸碱性根据溶液中c(OH+)、c(H+)的相对大小来判断,PH=7显中性,只在常温下成立.


科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是( )
A.分散系的分类: ![]()
B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到氢氧化钠溶液中,以制取Fe(OH)3胶体
D.如图显示的是树林的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有K+、Fe3+、Cl﹣、Mg2+、I﹣、CO32﹣、SO42﹣ , 限用的试剂有:盐酸硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( ) 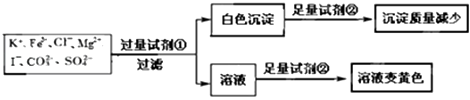
A.该溶液中一定有I﹣、CO32﹣、SO42﹣、K+
B.试剂①为硝酸钡
C.通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl﹣
D.试剂②一定为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空。
(1)工业制备硝酸流程如图1: 
①上述尾气中的NO一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为 .
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶、温度计、蒸馏烧瓶外,还需的玻璃仪器有 .
(2)某兴趣小组采用如图2装置制取并探究SO2气体的性质.
①下列实验方案适用于如图2所示装置制取所需SO2的是(填序号)
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4
②将SO2通入到以下有颜色的溶液中,溶液的颜色均褪去,其中属于漂白的是 .
A.紫色高锰酸钾溶液 B.氯水 C.品经溶液 D.红色酚酞溶液
③证明c中生成气体是SO2 , d中加入品红溶液后,打开活塞b,反应开始,待d中溶液后,再(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2 .
④指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如装置如图3,其中合理的是(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)═2C(g)+D(g),2min后B的浓度减少0.6molL﹣1 . 对2min内反应速率的表示正确的是( )
A.用A表示的反应速率是0.3molL﹣1min﹣1
B.分别用B C D表示的反应速率其比值为3:2:1
C.在2min末的反应速率,用B表示是0.3molL﹣1min﹣1
D.在2min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是( )
A.1mol/L
B.2mol/L
C.3mol/L
D.4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com