
【题目】实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3,反应原理为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,下列说法错误的是( )
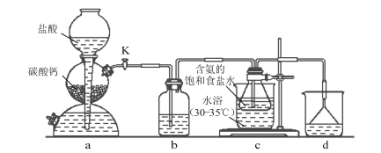
A.通过活塞K可控制CO2的流速
B.装置b、d依次盛装饱和Na2CO3溶液、稀硫酸
C.装置c中含氨的饱和食盐水提高了CO2吸收效率
D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.![]() 为V形的极性分子
为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中有7对完全相同的成键电子对
D.SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)易分解产生大量气体,常用作火箭推进剂。实验室可通过下列反应制取:NaClO4(aq)+ NH4Cl (aq)![]() NH4ClO4 (aq)+NaCl (aq)。
NH4ClO4 (aq)+NaCl (aq)。
(1)若 NH4Cl 用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是_____。
(2)根据如图的溶解度曲线,在反应后得到的混合溶液中获得 NH4ClO4 晶体的实验操作依次为:_____,洗涤,干燥。
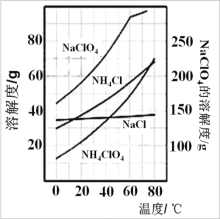
(3)在上述操作中,洗涤剂应选择_____
A. 热水 B. 乙醇 C. 冰水 D. 滤液
(4)样品中 NH4ClO4 的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),
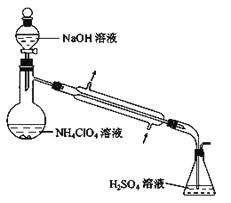
实验步骤如下:
步骤 1:按如图组装好仪器,准确称取样品 a g (约 0.5g) 于蒸馏烧瓶中,加入约 150mL 水溶解。
步骤 2:准确量取 40.00mL 约 0.1 mol·L-1H2SO4 溶液于锥形瓶中。
步骤 3:经滴液漏斗向蒸馏瓶中加入 20mL3molL-1NaOH 溶液。
步骤 4:加热蒸馏至蒸馏烧瓶中剩余约 100mL 溶液。
步骤 5:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 6:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,记录消耗NaOH 标准溶液的体积。
步骤 7:将实验步骤 1-6 重复 2 次。记录消耗 NaOH 标准溶液的平均体积为 V1 mL
步骤 8:在步骤 1 中不加入样品,将实验步骤 1-6 重复 3 次。记录消耗 NaOH 标准溶液的 平均体积为 V2 mL。
请回答:
①步骤 2 中,准确量取 40.00mL H2SO4 溶液的玻璃仪器是_____。
②为确保氨气被充分吸收的实验步骤为_________,为提高氨的吸收率,本实验还缺少的一步实验的步骤为_____
③请用含字母的表达式表示(如果有数字,请化简成一个数字)样品中 NH4ClO4 的含量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿莫西林是一种最常用的半合成青霉素类广谱β-内酰胺类抗生素,某研究小组按下列路 线合成:
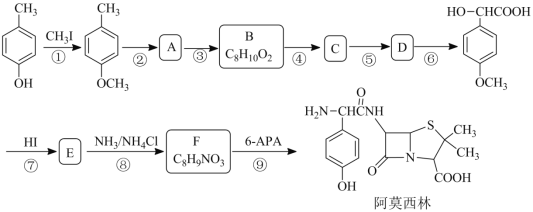
已知:
![]()
请回答:
(1)B 的结构简式为_____。
(2)下列说法正确的是_____。
A 化合物 B 的官能团是醛基 B 反应①的目的是为了保护酚羟基
C 化合物 D 能发生消去反应 D 阿莫西林的分子式是 C16H19N3O5S
(3)写出第⑨步反应的化学反应方程式_____。
(4)设计以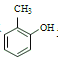 为原料制备水杨酸(
为原料制备水杨酸(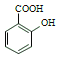 )的合成路线 (用流程图表示,无机试剂任选)_____。
)的合成路线 (用流程图表示,无机试剂任选)_____。
(5)写出同时符合下列条件的 F 的所有同分异构体的结构简式_____。
①分子中有苯环且是苯环的对位二取代物
②分子中含有硝基且不与苯环直接相连
③分子不与金属钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和Ni(OH)2电极。通过控制开关连接K1或K2,可交替得到H2和O2。下列说法错误的是( )
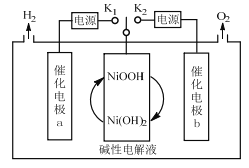
A.制O2时,电子由Ni(OH)2电极通过外电路流向催化电极b
B.制H2时,阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C.催化电极b上,OH-发生氧化反应生成O2
D.该装置可在无隔膜的条件下制备高纯氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CdSe)n小团簇(CdnSen,n=1~16)为Ⅱ-Ⅵ族化合物半导体材料,具有独特的光学和电学性质,常应用于发光二极管、生物系统成像与诊断等方面。
回答下列问题:
(1)基态Se原子的价层电子排布式为___。
(2)Cd的第一电离能大于同周期相邻元素,原因是___。
(3)CdS、CdSe、CdTe均为重要的Ⅱ-Ⅵ族化合物半导体材料,熔点分别为1750℃、1350℃、1041℃,上述熔点呈规律性变化的原因是___。
(4)利用有机配体PH3、N(CH3)3等修饰(CdSe)2可改善其光致发光效率。其中PH3的空间构型是___。N(CH3)3中参与形成配位键的孤电子对占据的轨道是___。
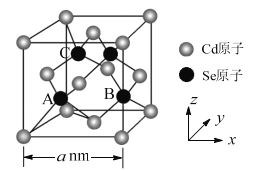
(5)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为(![]() ,
,![]() ,
,![]() ),则B、C的原子坐标参数分别为___。该晶胞中CdSe键的键长为___。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为___。
),则B、C的原子坐标参数分别为___。该晶胞中CdSe键的键长为___。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于溶液中的离子平衡。根据要求回答问題。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是______(填“强电解质”或“弱电解质”),其电离方程式____________________________________。
(2)已知:常温下0.1mol·L-1 BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈____性,请用离子方程式解释原因________________。
②当混合溶液pH=7时,溶液中离子浓度大小关系是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com