
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
【答案】(1)0.75 mol·L-1 (2)0.05mol/(L·min) (3)x=2
【解析】
考查可逆反应的有关计算,一般采用三段式。
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) n n 0 0
转化量(mol) 1.5 0.5 0.5x 1.0
5min后(mol) n-1.5 n-0.5 0.5x 1.0
(1)所以(n-1.5)(n-0.5)=3∶5
解得n=3
此时A的浓度是1.5mol÷2L=0.75 mol·L-1
(2)因为反应速率之比是相应的化学计量数之比
所以B的平均反应速率0.1mol/(L·min)÷2=0.05mol/(L·min)
(3)C的平均反应速率是0.1mol/(L·min)
所以0.1mol/(L·min)×2L×5min=0.5x
解得x=2


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(s)![]() 3C (g) ΔH=-a kJ·molˉ1 (a>0)。下列说法正确的是
3C (g) ΔH=-a kJ·molˉ1 (a>0)。下列说法正确的是
A.当体系中 3v (A)=v (C)时,则反应达到化学平衡
B.达到化学平衡后,生成 1mol A 的同时消耗 2mol B
C.达到化学平衡后,反应放出的热量一定小于 a kJ
D.达到化学平衡后,保持容积不变并通入惰性气体,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列反应装置模拟侯氏制碱法制备NaHCO3,反应原理为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,下列说法错误的是( )
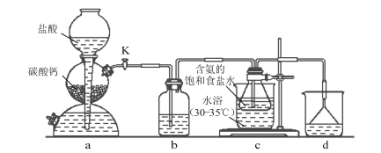
A.通过活塞K可控制CO2的流速
B.装置b、d依次盛装饱和Na2CO3溶液、稀硫酸
C.装置c中含氨的饱和食盐水提高了CO2吸收效率
D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳用不同催化剂催化生成一氧化碳的历程中能量的转变如图所示,(吸附在催化剂表面的用“·”表示)下列说法错误的是( )
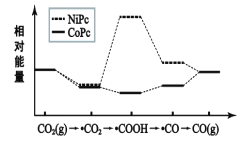
A.使用催化剂NiPc需要的条件更高
B.·COOH经过还原反应得到CO
C.反应过程中存在极性键的断裂和生成
D.相同微粒吸附在不同的催化剂时能量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)反应开始到10s,用Z表示的反应速率___________________
(2)反应开始到10s时,Y的转化率为__________________
(3)反应的化学方程式为:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素是一种金属化学元素,也是人体所必须的一种微量元素, 铜也是人类最早发现的金属,是人类广泛使用的一种金属,属于重金属。
(1)写出基态铜原子的价层电子排布式_________________。
(2)简单金属离子在水溶液中的颜色大多与价层电子中含有的未成对电子数有关,如Fe3+呈黄色,Fe2+呈绿色,Cu2+呈蓝色等。预测Cu+为_____色,解释原因________________。
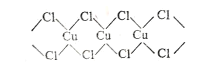
(3)X射线研究证明,CuCl2的结构为链状,如图所示,它含有的化学键类型为_________,在它的水溶液中加入过量氨水,得到 [Cu(NH3)4]Cl2溶液, [Cu(NH3)4]Cl2中H-N-H的夹角_________(填“大于”、“等于”或“小于”)NH3分子中的H-N-H的夹角,原因是___________。
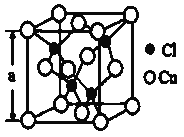
(4)某种铜的氯化物晶体结构如图:此晶体中铜原子的配位数是__________,若氯原子位于铜形成的四面体的体心,且铜原子与铜原子、铜原子与氯原子都是采取最密堆积方式,则氯原子与铜原子半径之比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期律,结合下列事实推测不合理的是()
事实 | 推测 | |
A | IVA族 | 同族 |
B | HI在230℃时分解,HCl在1500℃时分解 | HF分解温度大于1500℃ |
C | H3PO4是中强酸,H2SO4是强酸 | HClO4是强酸 |
D | Na、Al通常用电解法冶炼 | Mg可用电解法冶炼 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计SO2实验方案,做以下化学实验。
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2-饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,写出其中1个平衡方程式:________________________________________。
(2)已知:葡萄酒中有少量SO2可以做抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25 g·L-1]。
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:
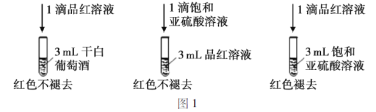
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_____________。
Ⅱ.实验方案二
如图2是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
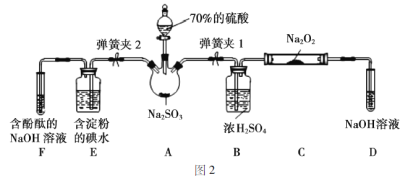
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_________________________。
(2)装置D中盛放NaOH溶液的作用是______________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为_____________;发生反应的离子方程式是______________。
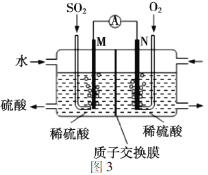
Ⅲ.实验方案三
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。M极发生的电极反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com