
【题目】已知:A(g)+2B(s)![]() 3C (g) ΔH=-a kJ·molˉ1 (a>0)。下列说法正确的是
3C (g) ΔH=-a kJ·molˉ1 (a>0)。下列说法正确的是
A.当体系中 3v (A)=v (C)时,则反应达到化学平衡
B.达到化学平衡后,生成 1mol A 的同时消耗 2mol B
C.达到化学平衡后,反应放出的热量一定小于 a kJ
D.达到化学平衡后,保持容积不变并通入惰性气体,平衡逆向移动
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1)![]() 是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
(2)![]() 的键角由大到小的顺序为________________________,
的键角由大到小的顺序为________________________,![]() 的第一电离能由大到小的顺序为_______________________________。
的第一电离能由大到小的顺序为_______________________________。
(3)![]() 是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
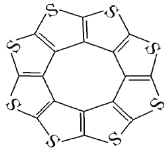
①![]() 分子中
分子中![]() 原子和
原子和![]() 原子的杂化轨道类型分别为_________________________。
原子的杂化轨道类型分别为_________________________。
②测得![]() 中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
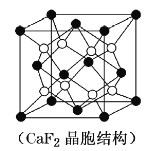
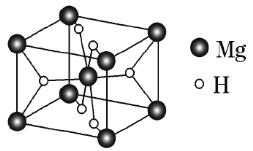
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构,![]() 原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将
原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将![]() 原子等同看待,该晶体储氢后的晶胞结构与
原子等同看待,该晶体储氢后的晶胞结构与![]() (如图)相似,该晶体储氢后的化学式为_________________________。
(如图)相似,该晶体储氢后的化学式为_________________________。
(5)![]() 是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为
是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为![]() ,则该晶胞的体积为___________
,则该晶胞的体积为___________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39 kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46 kJ/mol
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.84 kJ/mol
O2(g)=H2O(l) ΔH=-285.84 kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-319.68 kJ/molB.-417.91 kJ/mol
C.-448.46 kJ/molD.+546.69 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3-0.5n] m和绿矾(FeSO4·7H2O),过程如下:
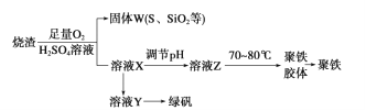
(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→______→_____→______→______→f。_________装置A中发生反应的化学方程式为___________。D装置的作用________。
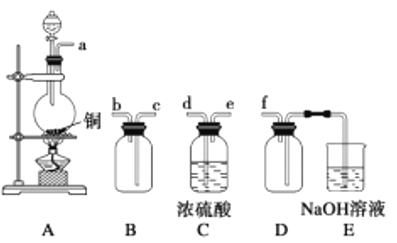
(3)制备绿矾时,向溶液X中加入过量_______,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有______________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( )
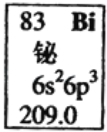
A. Bi元素的质量数是209
B. Bi元素的相对原子质量是209.0
C. Bi原子6p亚层有一个未成对电子
D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.![]() 为V形的极性分子
为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中有7对完全相同的成键电子对
D.SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)易分解产生大量气体,常用作火箭推进剂。实验室可通过下列反应制取:NaClO4(aq)+ NH4Cl (aq)![]() NH4ClO4 (aq)+NaCl (aq)。
NH4ClO4 (aq)+NaCl (aq)。
(1)若 NH4Cl 用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是_____。
(2)根据如图的溶解度曲线,在反应后得到的混合溶液中获得 NH4ClO4 晶体的实验操作依次为:_____,洗涤,干燥。
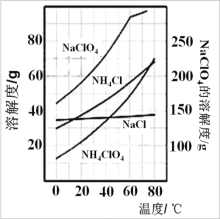
(3)在上述操作中,洗涤剂应选择_____
A. 热水 B. 乙醇 C. 冰水 D. 滤液
(4)样品中 NH4ClO4 的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),
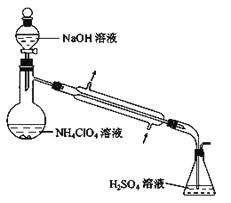
实验步骤如下:
步骤 1:按如图组装好仪器,准确称取样品 a g (约 0.5g) 于蒸馏烧瓶中,加入约 150mL 水溶解。
步骤 2:准确量取 40.00mL 约 0.1 mol·L-1H2SO4 溶液于锥形瓶中。
步骤 3:经滴液漏斗向蒸馏瓶中加入 20mL3molL-1NaOH 溶液。
步骤 4:加热蒸馏至蒸馏烧瓶中剩余约 100mL 溶液。
步骤 5:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 6:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,记录消耗NaOH 标准溶液的体积。
步骤 7:将实验步骤 1-6 重复 2 次。记录消耗 NaOH 标准溶液的平均体积为 V1 mL
步骤 8:在步骤 1 中不加入样品,将实验步骤 1-6 重复 3 次。记录消耗 NaOH 标准溶液的 平均体积为 V2 mL。
请回答:
①步骤 2 中,准确量取 40.00mL H2SO4 溶液的玻璃仪器是_____。
②为确保氨气被充分吸收的实验步骤为_________,为提高氨的吸收率,本实验还缺少的一步实验的步骤为_____
③请用含字母的表达式表示(如果有数字,请化简成一个数字)样品中 NH4ClO4 的含量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com