
【题目】铜元素是一种金属化学元素,也是人体所必须的一种微量元素, 铜也是人类最早发现的金属,是人类广泛使用的一种金属,属于重金属。
(1)写出基态铜原子的价层电子排布式_________________。
(2)简单金属离子在水溶液中的颜色大多与价层电子中含有的未成对电子数有关,如Fe3+呈黄色,Fe2+呈绿色,Cu2+呈蓝色等。预测Cu+为_____色,解释原因________________。
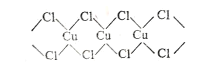
(3)X射线研究证明,CuCl2的结构为链状,如图所示,它含有的化学键类型为_________,在它的水溶液中加入过量氨水,得到 [Cu(NH3)4]Cl2溶液, [Cu(NH3)4]Cl2中H-N-H的夹角_________(填“大于”、“等于”或“小于”)NH3分子中的H-N-H的夹角,原因是___________。
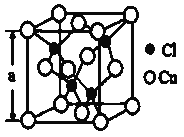
(4)某种铜的氯化物晶体结构如图:此晶体中铜原子的配位数是__________,若氯原子位于铜形成的四面体的体心,且铜原子与铜原子、铜原子与氯原子都是采取最密堆积方式,则氯原子与铜原子半径之比为__________________。
【答案】3d104s1 无 Cu+中无单电子 共价键、配位键 大于 [Cu(NH3)4]Cl2 中氮原子无孤电子对,NH3 中氮原子有孤电子对,孤电子对对成键电子排斥力大,键角小 4 ![]()
【解析】
(1)铜是29号元素,核外电子排布式为1s22s22p63s23p63d104s1,价层电子排布式3d104s1,故答案为:3d104s1;
(2) 根据价层电子排布,Fe3+有5对未成对电子,呈黄色;Fe2+有4对未成对电子,呈绿色,可知Cu+无颜色,因为Cu+中无单电子,故答案为:无;Cu+中无单电子;
(3)根据氯化铜的结构可知分子中含有的化学键类型为共价键、配位键;NH3中N原子含有3个共价键和1个孤电子对,由于NH3提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小,故答案为:共价键、配位键;大于; [Cu(NH3)4]Cl2 中氮原子无孤电子对,NH3 中氮原子有孤电子对,孤电子对对成键电子排斥力大,键角小;
(4)晶胞中Cl原子数目为4,晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4;若C1原子位于Cu原子构成的四面体体心,则体对角线是铜原子和氯原子的半径之和的4倍,Cu原子位于立方体的顶点和面心,为面心立方最密堆积,则面对角线是铜原子半径的4倍,设晶胞的边长为a cm,面对角线等于
=4,二者原子数目为1∶1,故配位数也相等,Cu原子与周围4个Cl原子形成正四面体,Cu的配位数为4;若C1原子位于Cu原子构成的四面体体心,则体对角线是铜原子和氯原子的半径之和的4倍,Cu原子位于立方体的顶点和面心,为面心立方最密堆积,则面对角线是铜原子半径的4倍,设晶胞的边长为a cm,面对角线等于![]() ,则铜原子半径为
,则铜原子半径为![]() ,体对角线等于
,体对角线等于![]() ,则氯原子半径为
,则氯原子半径为![]() ,则氯原子与铜原子半径之比等于
,则氯原子与铜原子半径之比等于![]() ,故答案为:4;
,故答案为:4;![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( )
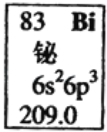
A. Bi元素的质量数是209
B. Bi元素的相对原子质量是209.0
C. Bi原子6p亚层有一个未成对电子
D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和Ni(OH)2电极。通过控制开关连接K1或K2,可交替得到H2和O2。下列说法错误的是( )
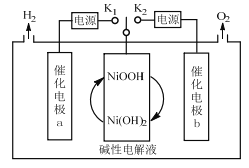
A.制O2时,电子由Ni(OH)2电极通过外电路流向催化电极b
B.制H2时,阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O
C.催化电极b上,OH-发生氧化反应生成O2
D.该装置可在无隔膜的条件下制备高纯氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在某温度下,发生反应:
NH4I(气)![]() NH3(气)+HI(气),2HI(气)
NH3(气)+HI(气),2HI(气)![]() H2(气)+I2(气)
H2(气)+I2(气)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)= 4mol/L,则NH3的浓度为
A.3.5mol/LB.4.5mol/LC.4mol/LD.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是()
A.相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-)
B.相同质量的钠分别完全转化为Na2O和Na2O2时转移的电子数
C.相同物质的量的丙烷和2-甲基丙烷中所含C-H键的数目
D.标准状况下,相同体积的乙炔和苯中所含的H原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用香料A分子中无支链,B分子中无甲基,B能使Br2的CCl4溶液褪色,1mol B与足量Na反应生成0.5mol H2,各物质间有如图1转化。
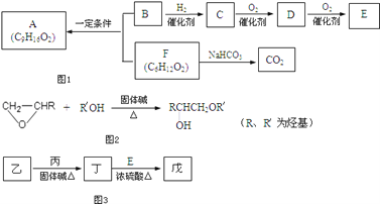
回答下列问题:
(1)在一定条件下能与C发生反应的是____;
a.Na b.Na2CO3 c.Br2/CCl4 d.CH3COOH
(2)D分子中的官能团名称是____,E的结构简式是____;
(3)B与F反应生成A的化学方程式是____;
(4)F的某种同分异构体甲能发生水解反应,其中的一种产物能发生银镜反应;另一产物在光照条件下的一氯取代物只有两种,且催化氧化后的产物也能发生银镜反应。则甲的结构简式是____;
(5)已知醇与某类环醚类之间在和固体碱共热的环境下会有如图2反应:从反应机理分析,该反应类型可称为____;
(6)工业上由乙出发可以合成有机溶剂戊(C7H14O3),流程图示见图3,
已知:①乙是C的同系物,其催化氧化产物在常温下为气态;②丁分子中有2个甲基,推测戊的结构简式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(OH)能氧化降解有机污染物。下列说法错误的是
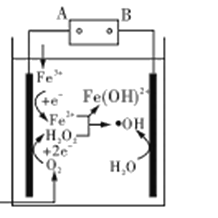
A.电源的A极为负极
B.每消耗2. 24 LO2(标准状况),整个电解池中理论上可产生的OH为0.2 mol
C.与电源B极相连电极的电极反应式为:H2O-e-=H++﹒OH
D.H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++﹒OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com