
【题目】关于下列各装置图的叙述中正确的是( )
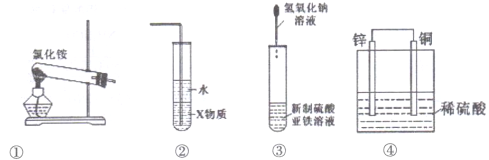
A. 装置①可用于实验室用制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是原电池,锌电极为负极,发生还原反应
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
B.大理石与稀硝酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.硫酸溶液与氧氧化钡溶液混合:H++SO42-+Ba2++OH-=H2O+BaSO4↓
D.MgC12溶液与过量氨水反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是______。
A.14N与15N为同种核素 B.14N的第一电离能小于14C
C.15NH3与14NH3均能形成分子间氢键 D.14CH315NH2与CH3CH2NH2互为同系物
(2)15N的价层电子排布图为_______,15NH4Cl的晶胞与CsCl相同,则15NH4Cl晶体中15NH4+的配位数为_____;15NH4+中15N的杂化轨道类型为_________。
(3)工业上电解法处理亚硝酸盐的模拟工艺如图:
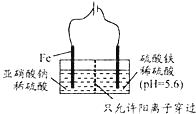
已知:阳极区发生化学反应:2N02+8H++6Fe2+═N2↑+6Fe3++4H2O
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为________(填化学式); 该现象表明c(H+)越大,H+氧化性越_______;
③若电解时电路中有0.6mol电子转移,且NaNO2有剩余,则电解池中生成________molNa2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、 HCO3-
C. K+、 Na+、 NO3-、 MnO4- D. Al3+、Mg2+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素。
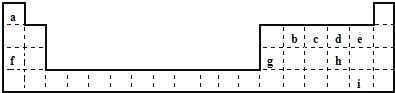
请回答下列问题:
(1)b、c、d三种元素的原子半径最大的是_________ (填元素符号);f、g对应的离子中离子半径较大的是_________(填离子符号)。
(2)i元素在周期表中的位置为_________;在元素 b、c、d、e、h、i的氢化物中,热稳定性最强的是________(填氢化物的化学式)。
(3)d、f、h三种元素形成的具有较强还原性的化合物A,与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯气体,该反应的离子方程式为_________ ;生成 标准状况下56L二氧化氯时,转移电子的数目为_________个。
(4)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的离子方程式:①________;②________。所得溶液中溶质物质的量浓度为__________(液体的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=lg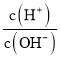 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是( )
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是( )
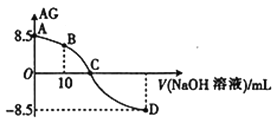
A. D点溶液中的pH=11.25
B. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积为20.00mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.7 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.7 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为
A. 2.8 B. 18.8 C. 21.6 D. 29.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.金属钠的熔点很高
C.做钠与水反应时,要用到的仪器有镊子、小刀、滤纸、烧杯、玻璃片
D.将金属钠放在石棉网上加热后,金属钠剧烈燃烧,产生黄色火焰,生成白色固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com